Estudio in silico de difusión en los tegumentos de los vertebrados e invertebrados acuáticos en diferentes condiciones de salinidad y funcionamiento del sistema renal en mamíferos
La fisiología hidrosalina y la renal están íntimamente relacionadas en los animales, y son claves para el buen desenvolvimiento de estos, especialmente en medio acuáticos. En este sentido, se presenta el estudio in silico de los procesos de difusión ocurridos a nivel del tegumento de vertebrados e invertebrados acuáticos sometidos a agua salada y agua dulce. Para esto se empleó el software PhysioEx 6.0, el cual permitió registrar las velocidades de difusión promedio de NaCl entre el plasma y el medio exterior acuoso. Se determinó que en vertebrados, la velocidad promedio de difusión es mayor que la basal cuando se someten a agua salada, mientras que esta es menor cuando se someten a agua dulce. Por el contrario, en invertebrados acuáticos la velocidad de difusión es siempre más baja tanto en agua salada como en dulces respecto de la basal, pero esta es particularmente muy baja en el agua salada.
Por otra parte, se describe el proceso de determinación del efecto que tienen las hormonas ADH y aldosterona, y el gradiente de solutos sobre la formación de orina. Siendo en ADH la hormona que más disminuye los volúmenes de orina obtenidos. Finalmente, también se describe el efecto del aumento de la presión sanguínea y el cambio en el diámetro de la arteriola aferente, sobre la tasa de filtración glomerular, la presión glomerular y la cantidad de orina formada.
1. INTRODUCCIÓN
Cada célula de los animales está rodeada por una membrana plasmática que la aísla del medio exterior de manera selectiva, siendo permeable a iones, líquido, gases y otras sustancias en forma diferencial. Esto lo logran mediante cambios en la composición lipídica y proteica de la membrana, tales que permiten la entrada y salida específica de sustancia gaseosas de pequeño tamaño, iones, y otras moléculas orgánicas grandes como azucares (Campbell et al., 2016).
Así, el paso espontáneo de moléculas desde un fluido con mayor concentración hacia uno de menor concentración a través de una membrana biológica se denomina difusión simple. En algunos casos las sustancias que por su naturaleza química y tamaño no permean fácilmente las membranas lo hacen a través de canales proteicos (tipo proteínas integrales), en un proceso llamado difusión facilitada. Por su parte, cuando la permeabilidad de la membrana a iones, y otras sustancias es muy limitada, el agua del fluido es la que permea a través de la membrana siguiendo también un gradiente, de un área de mayor concentración de agua (menor de solutos) a una de menor concentración (mayor de solutos), fenómeno conocido como ósmosis (Lodish et al., 2016).
En vista del aislamiento físico parcial de las células (y por tanto de los tejidos), los animales han desarrollado distintas estrategias para regular la pérdida o ganancia de agua, iones y otras sustancias hacia y desde el medio en el que se desenvuelven. En este sentido, uno de los mecanismos existentes es la regulación osmótica u osmorregulación, que consiste en el mantenimiento de presiones osmóticas (presión creada en el área hacia la que se desplazó el agua después de la ósmosis) constantes en el plasma sanguíneo, de manera tal que se haga factible la pérdida, ganancia o mantenimiento de agua e iones en los fluidos corporales (Hill et al., 2012). En el caso de organismos acuáticos cuyos tegumentos se encuentran constantemente expuestos a las condiciones osmóticas del agua, mayormente debido a la necesidad de respirar, la tarea de controlar la tasa a la que se dan los procesos de ósmosis y difusión es fundamental (Peterson et al., 2006).
Es por esto que han desarrollado tegumentos que son permeables en mayor o menor medida al agua y a los solutos en esta, en conjunto con sistemas que desechen el exceso de iones y agua como el sistema excretor y renal respectivamente. Si bien existe la osmorregulación, algunos animales, como la mayoría de los invertebrados marinos, varían su presión osmótica en el plasma en la misma proporción en la que el agua exterior lo hace, siendo denominados conformistas osmóticos (Hill et al., 2012).
En virtud de lo antes expuesto, se presenta el estudio in silico de los procesos de difusión que ocurren en el tegumento de vertebrados e invertebrados acuáticos ante las diferentes concentraciones de salinidad externas. De forma similar, se describe el funcionamiento del sistema renal en mamíferos mediante la evaluación del efecto de la vasoconstricción, vasodilatación, presión sanguínea, gradiente de solutos y la presencia de hormonas sobre la filtración glomerular y la formación de orina.
2. MATERIALES Y MÉTODOS
Todos los procedimientos se llevaron a cabo como se especifica en la “Guía de prácticas de fisiología animal” (Andara & Sánchez, 2016), mediante el uso del software simulador PhysioEx (Laboratory Experiments in Physiology).
3. RESULTADOS Y DISCUSIÓN
3.1. Difusión en tegumentos de vertebrados e invertebrados marinos sometidos a soluciones de agua salada y dulce
En la Figura 1 se muestran las gráficas del cambio en las velocidades de difusión de NaCl en función del aumento del peso molecular límite (MWCO por Molecular Weight Cut Off) del poro de la membrana de diálisis empleada para simular el tegumento de animales vertebrados (Fig. 1a) e invertebrados marinos (Fig. 1b).
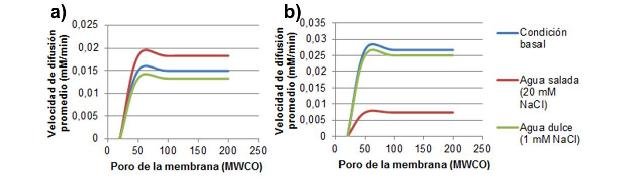
Figura 1. Velocidad de difusión promedio de NaCl en función del tamaño del poro de la membrana de diálisis. Se observan los tratamientos con agua salada y con agua dulce y en condición basal (con agua desionizada). a) Datos de vertebrados marinos. b) Datos de invertebrados marinos.
Se observó que la velocidad de difusión promedio del NaCl en los vertebrados marinos en condiciones basales fue menor que la obtenida en invertebrados. Por su parte, al someter al tratamiento con agua salada la velocidad de difusión aumentó en el caso de los vertebrados y disminuyó drásticamente en los invertebrados. Finalmente, al someter a agua dulce se observa una disminución leve de la velocidad de difusión respecto de la basal en ambos casos.
Los poros de las membranas no permitieron el paso del NaCl solo en 20 MWCO, de manera que el al aumentar el tamaño, el paso del NaCl y su velocidad se hacen independientes del tamaño del poro. Siendo esto así, la diferencia de velocidades promedio en los distintos casos se explica ya que la velocidad de difusión de un ión o sustancia a través de una membrana es proporcional a la magnitud del gradiente de concentración entre ambos lados de esta (Randall et al.,1999). De manera que mientras mayor sea el gradiente de concentración entre el plasma sanguíneo y el ambiente, mayor será la difusión observada, y la dirección de movimiento irá desde la zona más concentrada a la menos concentrada (Lodish et al., 2016). Así, el gradiente entre el plasma sanguíneo y el agua desionizada en vertebrados era menor en comparación con el de invertebrados, me manera que en el primero el proceso de difusión se daba más lento aun cuando el paso de los iones no se veía restringido por las membranas después de 50 MWCO.
Al tratar con agua salada, el NaCl tendió a salir con mayor velocidad en el tegumento de los vertebrados, ya que en estos la concentración de la sal es menor que en el agua salada o de mar mientras que en invertebrados cuyas concentraciones de NaCl internas eran muy similares a las del agua salada, la velocidad de difusión fue muy baja. Finalmente, al tratar con agua dulce cuyas concentraciones de NaCl son casi idénticas a las del agua desionizada, la gran velocidad de difusión observada en ambos casos se debió al amplio gradiente. Las diferencias entre vertebrados e invertebrados respecto a este último tratamiento, nuevamente se explican en función de la magnitud inicial del gradiente plasma-exterior.
A juzgar por los resultados, los tegumentos de los vertebrados e invertebrados deben encontrarse entre los 20 MWCO y los 50 MWCO ya que por debajo de esto no hay intercambio de iones y por encima la diferencia es despreciable, y se sabe que es necesaria cierta permeabilidad para la regulación hídrica, gaseosa y salina de los organismos (Hill et al., 2012). De manera que (1) es imposible que los tegumentos se aíslen por completo, pues limita la obtención de agua, sales y oxígeno y como consecuencia (2) siempre ocurrirán procesos de ósmosis y difusión en simultáneo, exigiendo entonces (3) que los organismos desarrollen mecanismos para regular las presiones osmóticas y el balance salino.
El primer mecanismo o barrera que se puede regular, es como se observó, la permeabilidad de las membranas que tienen contacto con el agua tanto a esta como a los iones o sales. Lo cual a nivel celular implica que: (1) existan zonas casi por completo impermeables, mediante el depósito de sustancias de esta naturaleza en las capas de tejido más externas, y (2) zonas que son más o menos permeables (como las branquias, que requieren serlo para captar oxigeno) en función del qué tan estrechamente unidas se encuentren las células de la epidermis, en función del número de transportadores pasivos o activos en la membrana, y en función de la proporción de lípidos con características polares y apolares encontrados en esta (Lodish et al., 2016; Hill et al., 2012).
En los experimentos realizados quedó además en evidencia que los animales invertebrados acuáticos (al menos los que coinciden con los valores salinos del plasma tomados como referencia) son hiperosmóticos respecto del agua dulce y aproximadamente isoosmóticos respecto al agua salada. De manera que ganan agua por ósmosis y pierden sales en el agua dulce por difusión, y en agua salada tienden a ganar pocas sales y a perder poca agua. En función de esto, los invertebrados acuáticos en agua dulce tienden a generar grandes cantidades de orina hipoosmótica para eliminar el exceso de agua, y a tomar iones del medio a través de transporte activo y de la alimentación para compensar la pérdida por difusión (Hill et al., 2012). Por su parte, en agua salada los invertebrados marinos isoosmóticos o ligeramente hipoosmóticos no tienen que lidiar con problemas de desbalances salinos e hídricos, en especial si se trata de especies conformistas. En algunas especies reguladoras hipoosmóticas, se observa la producción de orina hiperosmótica respecto del plasma sanguíneo para eliminar iones, y la captación de agua al beberla (Hill et al., 2012).
Finalmente, se evidenció que los vertebrados (nuevamente, cuyos valores salinos en plasma coinciden con los tomados como referencia) son hipoosmóticos respecto al agua de salada e hiperosmóticos (pero en menor proporción que los invertebrados) respecto del agua dulce. De manera que tienden a perder agua y ganar iones en el agua de mar, y a ganar agua y perder iones en el agua dulce. En agua salada se sabe que algunos mecanismos son: (1) tomar agua del medio para reponer la pérdida, (2) absorción del agua del 70 al 80 % del agua a través de las paredes intestinales, (3) eliminación del exceso de sales por transporte activo a través del tegumento o branquias y (4) excreción del exceso de sales mediante producción de orina hiperosmótica (Willmer et al., 2005). En el caso de los vertebrados de agua dulce, estos presentan mecanismos similares a los antes mencionados para los invertebrados (Hill et al., 2012).
3.2. Influencia de la presión sanguínea y de la vasoconstricción y vasodilatación sobre la filtración glomerular y la formación de orina en mamíferos
La tasa de filtración glomerular aumentó de manera casi proporcional con el incremento de la presión sanguínea (Fig. 2a), observando además un aumento lento de la producción de orina hasta por encima de los 200 mL. Por su parte, la presión glomerular fue aumentando ligeramente a medida que el radio de la arteriola aferente aumentaba (Fig. 2b), e igualmente lo hizo la cantidad de orina producida, que en un radio de 0,3 no se producía en lo absoluto.
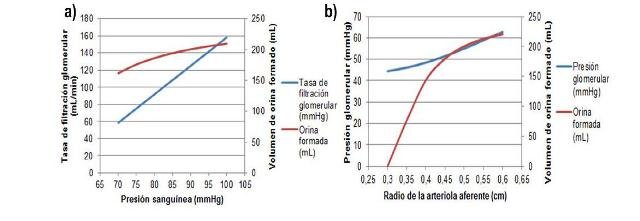
Figura 2. Tasa de filtración glomerular en función de la presión sanguínea (a)) y presión glomerular en función del radio de la arteriola aferente (b)).
Adicionalmente, se muestran las cantidades de orina formadas, en función de ambos parámetros.
El proceso de filtración glomerular en sí se debe principalmente a que la alta presión que existe en los capilares del glomérulo obligan a molécula pequeñas como el agua, glucosa, aminoácidos, sales y urea pasen desde la sangre en la cápsula glomerular a través de la membrana basal de la cápsula de Bowman hacia el nefrón, excluyendo a moléculas grandes como células y proteínas (Lote, 2012). Estas altas presiones se generan básicamente debido a que la arteria renal recibe sangre de muy alta presión proveniente del circuito arterial, y debido a que la arteriola aferente desemboca en la arteriola eferente cuyo diámetro es mucho menor, incrementando la presión en la primera (principio de Bernoulli) (Hill et al., 2012).
En los experimentos realizados, se modifican precisamente los dos parámetros antes mencionados. Al aumentar la presión sanguínea (ya sea por hipertensión o aumento del volumen de sangre neto) la sangre que entra por la arteriola aferente trae cada vez mayor presión, y por tanto la presión en los capilares que conectan con la arteriola eferente es mayor, lo cual obliga a más moléculas a ser filtradas y a una mayor tasa. Es por esto que se observa un aumento en la tasa de filtración glomerular, y en consecuencia en la cantidad de orina producida.
De manera similar, la disminución del radio de la arteriola aferente implica que su tamaño es cada vez más similar al tamaño de la arteriola eferente, disminuyendo tanto la presión a nivel de los capilares del glomérulo que la filtración es casi imposible, resultado en una producción nula de orina. Al aumentar el diámetro de la arteriola aferente, este es cada vez más grande que en la arteriola eferente, lo cual resulta en un aumento de la presión en los capilares y por tanto en una mayor tasa de filtración y por tanto de orina producida. El aumento o disminución del diámetro de la arteriola aferente, simula y responde a lo observado en procesos de vasoconstricción y vasodilatación.
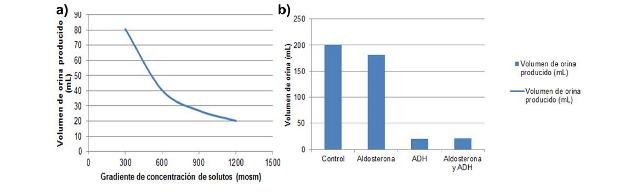
3.3. Efecto de las hormonas y del gradiente de concentración de solutos sobre la formación de orina en mamíferos
En la Figura 3 se muestran los volúmenes de orina formados por los glomérulos en función del gradiente de concentración de solutos entre el espacio nefronal y los túbulos renales (Fig. 3a) y de distintas hormonas (Fig.3b). Se puede detallar que la producción de orina disminuye a medida que aumenta el gradiente de concentración de solutos.

Figura 3. Volumen de orina formado en función del gradiente de concentración de solutos entre el espacio nefronal y los túbulos renales (a)) y en función del tratamiento con las hormonas ADH y aldosterona (b)).
Adicionalmente, se pudo determinar que en presencia de vasopresina, u hormona antidiurética (ADH) la formación de orina fue mucho mayor que en condiciones normales y en presencia de aldosterona y de aldosterona y ADH juntas. En este sentido, lo observado se corresponde al hecho de que la vasopresina es una hormona cuya liberación desencadena el aumento de la permeabilidad al agua de las membranas de las células que se encuentran en el tubo colector, de manera que al llegar la orina a este útimo punto, se concentra pues el agua es recuperada al espacio nefronal porque esta permea ahora más facil (Nielsen et al., 1995). Por su parte, la aldosterona regula los canales de sodio de las células epiteliales del tubo colector en el riñon, incrementando la permeabilidad al sodio y por tanto su absorción, simultaneamente incrementando la secreción de potasio hacia fuera del ducto o tubo y por tanto influenciando indirectamente la disminución leve de la producción de orina por retención de agua (Palmer & Frindt, 2000).
Debido a que ambas hormonas actuan en sitios y mediante mecanismos diferentes, se pudo evaluar su efecto juntas, observandose que la ADH predomina sobre la aldosterona, causando uan disminución drástica de la orina producida. Finalmente, el efecto del gradiente de concentración puede explicarse mediante el fenómeno de la ósmosis, ya que al haber una mayor concentración de solutos en el espacio circundante a los túbulos renales más agua tiende a salir de estos en las zonas permeables, de manera que la cantidad de orina final es menor y más concentrada (Hill et al., 2012).
4. CONCLUSIONES
• La velocidad de difusión promedio en estado basal (tratados con agua desionizada) es mayor en invertebrados que en vertebrados.
• En vertebrados, la velocidad promedio de difusión es mayor que la basal cuando se someten a agua salada, mientras que esta es menor cuando se someten a agua dulce.
• Por el contrario, en invertebrados acuáticos la velocidad de difusión es siempre más baja tanto en agua salada como en dulces respecto de la basal, pero esta es particularmente muy baja en el agua salada.
• El aumento de la presión sanguínea incrementa de manera casi proporcional la tasa de filtración glomerular y por tanto la cantidad de orina producida.
• El aumento del radio de la arteriola aferente incrementa la presión en el glomérulo y la cantidad de orina que se produce.
• Presiones glomerulares muy bajas, producto de arteriolas aferentes con pequeños radios puede impedir la formación de orina.
• El aumento del gradiente de concentración de solutos entre el espacio nefronal y los túbulos renales disminuye la producción de orina.
• La vasopresina disminuye drásticamente el volumen de orina formada normalmente. En presencia de aldosterona aun predomina su efecto.
• La aldosterona disminuye muy ligeramente la producción de orina.
5. REFERENCIAS BIBLIOGRÁFICAS
Andara, C. & E. Sánchez. Guía de prácticas de fisiología animal. (2016). Universidad de Carabobo, Facultad de Ciencias y Tecnología, Departamento de Biología. Carabobo, Venezuela. 71 pp.
Campbell, N., J. Reece, L. Urry, M. Cain, S. Wasserman, P. Minorsky & R.
Jackson. (2014). Biology. Pearson Education, Inc. New York, Estados Unidos de América. 1010 pp.
Hill, R., G. Wyse, & M. Anderson. (2012). Animal physiology. Sinauer Associates, Inc. Publishers. Massachussets, Estados Unidos de América. 916 pp.
Lodish, H., A. Berk, C. Kaiser, M. Krieger, A. Bretscher, H. Ploegh, A. Amon & K. Martin. (2016). Molecular Cell Biology. W. H. Freeman and Company. New York. 1170 pp.
Lote, C. (2012). Principles of Renal Physiology. Springer Science. New York, Estados Unidos de América. 193 pp.
Nielsen, S., C. Chou, D. Marples, E. Christensen, B. Kishore & M. Knepper. (1995). Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channels to plasma membrane. Proceedings of the National Academy of Sciences of the United States of America. 92(4): 1013-1017.
Palmer, L., & G. Frindt. (2000). Aldosterone and potassium secretion by the cortical collecting duct. Kidney International. 57 (4): 1324-1328.
Peterson, G., L. Smith & S. Timothy. (2006). PhysioexTM 6.0 para fisiología humana: simulaciones de laboratorio de fisiología. Pearson & Addison Wesley. Madrid, España. 192 pp.
Randall, D., W. Burggren & K. French. (1999). Eckert: Fisiología animal. Mecanismos y adaptaciones. McGraw-Hill Interamericana. Madrid, España. 790 pp.
Willmer, P., G. Stone & I. Johnston. (2005). Enviromental physiology of animals. Blackwell publishing. Massachusetts, Estados Unidos de América. 706 pp.
Investigación y ciencia son los pilares de naciones desarrollada..! ¡Votado por Engranaje!
¡Felicidades, #proconocimiento te valoró!
Has sido reconocido(a) por tu buen post por el Comité de Arbitraje y Valoración del Proyecto Conocimiento @proconocimiento.
Apoyamos y valoramos tu esfuerzo...
Proyecto Conocimiento es parte de la comunidad @provenezuela.
Pioneros en la plataforma #steemit en el reconocimiento y valoración a la Producción Intelectual en habla hispana.
Congratulations @khrisaeroth! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPCongratulations @khrisaeroth! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPCongratulations @khrisaeroth! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPCongratulations @khrisaeroth! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Congratulations @khrisaeroth! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Congratulations @khrisaeroth! You received a personal award!
Click here to view your Board
Congratulations @khrisaeroth! You received a personal award!
You can view your badges on your Steem Board and compare to others on the Steem Ranking
Vote for @Steemitboard as a witness to get one more award and increased upvotes!