Todos los metales son propensos a sufrir corrosión por la acción de las condiciones ambientales. La corrosión es un proceso degenerativo en donde están implícitas dos reacciones químicas, la oxidación y la reducción.
Estructura interna de un ánodo de sacrificio
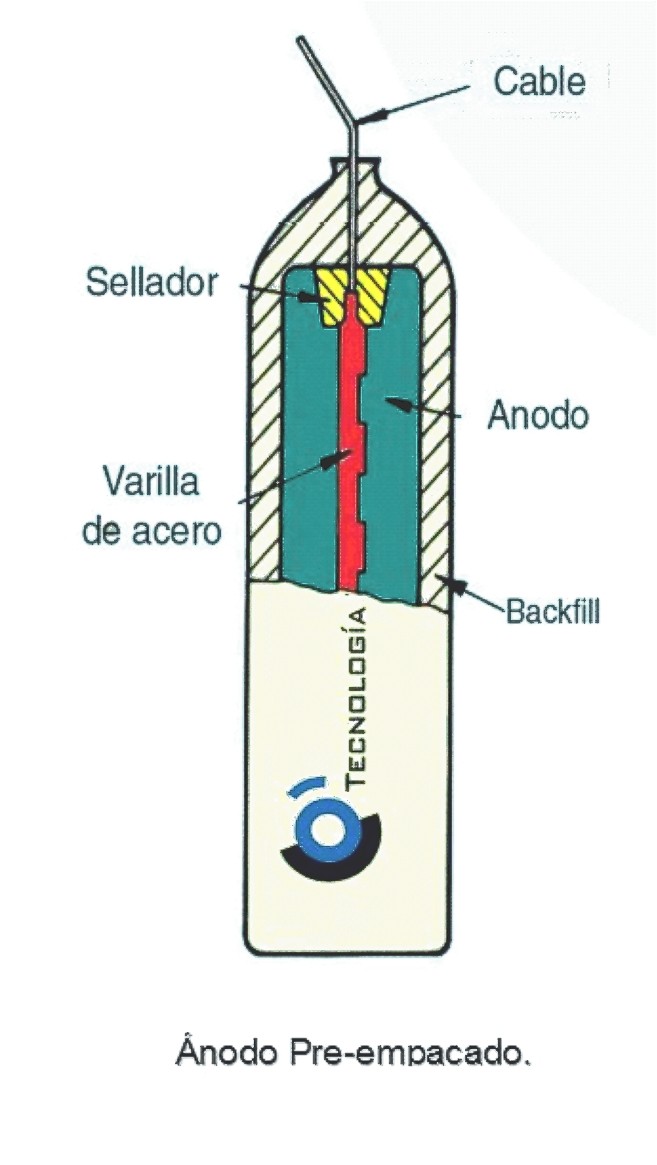
Fuente
Oxidación:
Se refiere a la reacción química en donde ocurre la perdida de electrones, en el proceso de corrosión esta asociada directamente a la degeneración de los metales.
Ejemplo:
Fe → Fe2+ + 2e−
El hierro pierde dos electrones oxidándose.
Reducción:
Es la reacción química donde ocurre una ganancia de electrones, en la corrosión por lo general esta asociada al efecto de sales, halógenos, el oxígeno, el agua, entre otros factores ambientales.
Ejemplo:
2H2O + 2e− → H2 + 2OH−
En la molécula de agua el hidrógeno gana dos electrones para convertirse en hidrógeno gaseoso e hidróxido.
En los ejemplos anteriores se muestran las reacciones de oxidación y reducción que ocurren en la corrosión del hierro por acción del agua.
Efecto de la corrosión en una tubería metalica
.jpeg)
Fuente
En muchos casos resulta difícil evitar que en estructuras metálicas se den estas reacciones, sobre todo en ambientes marinos o con alta presencia iónica, pero entonces surge la necesidad de buscar un mecanismo, que nos permita proteger lo mejor posible de la corrosión a los metales, para ayudarnos a cumplir este objetivo se diseñaron los ánodos de sacrificios.
Que son los ánodos de sacrificio?
Son dispositivos diseñados para proteger de la corrosión los metales, al presentar su componente principal un bajo potencial de reducción, actuaran como donadores de electrones en la reacción redox del proceso de corrosión, degradándose estos y protegiendo la estructura metálica a la cual se fijen.
Por lo general para la elaboración de ánodos de sacrificio, deben utilizarse metales con un bajo costo y con buenas características de conductividad eléctrica, los metales más comúnmente usados para este fin son: el zinc, magnesio y aluminio.
Ánodos de sacrificio utilizados en cubiertas de barcos
.jpeg)
Fuente
Cuando un metal entra en contacto con otro que tenga un potencial de reducción mayor al de él, se oxidara debido a que formara una especie de celda electroquímica, donde actuara como un ánodo siendo la especie que cede sus electrones.
Se han preguntado alguna vez, porque cuando colocamos una cadena de plata al lado de una de oro, la plata se oxida?
La respuesta nos la dan los potenciales de reducción de ambos metales que encontraremos en la siguiente imagen:
Potenciales de reducción de los metales

Fuente
Como se observa la plata (Ag) presenta un potencial de reducción de 0,799 voltios, mucho menor al del Oro (Au) que es de 1,5 voltios. Lo que esto significa es que el oro presentara una mejor tendencia a la captación de electrones, es decir a la reducción, la plata por el contrario al tener un potencial de reducción bajo en relación al oro, sera la especie donadora de electrones y por consiguiente la que se oxide al poner a estos metales en contacto.
Ventajas de algunos metales.
Como mencione anteriormente, los metales mas utilizados para la fabricación de los ánodos de sacrificio son: el zinc, magnesio y aluminio. La razón de su uso son los bajos potenciales de reducción que poseen y que no representan altos costos.
Si se fijan con detenimiento en la tabla de los potenciales de reducción, podrán darse cuenta que estos tres metales presentan potenciales negativos, lo que nos dice que son muy propensos a la oxidación y por ende ofrecen grandes características para usarse en tal fin.
Ánodos de sacrificio de una aleación con magnesio
.jpg)
Fuente
También en pueden utilizarse aleaciones de metales en la fabricación de los ánodos de sacrificio, la selección de estos dependerá de las características de las estructuras metálicas que se deseen proteger.
Características que debe poseer un ánodo de sacrificio.
Presentar un bajo potencial de reducción, en la mayoría de los caso se requiere que este sea negativo, para incrementar la diferencia de potenciales, entre este y la superficie metálica a proteger de la corrosión.
Que tenga un bajo costo económico, este punto es muy importante ya que se requiere que el material a sacrificar sea mas barato que el que se desea proteger.
Que presente buenas condiciones de conductividad.
Que tenga la capacidad de corroerse de manera uniforme y ofrezca durabilidad.
Cálculos de eficiencia de un ánodo de sacrificio.
Para saber que tan eficiente sera un ánodo de sacrificio, así como saber la cantidad de ánodos que necesitaremos para proteger determinada superficie metálica, es necesario que conozcamos la Intensidad de la corriente anódica teórica, la cual estará sujeta a la ley de ohm.
Intensidad anódica = (∆V)/ R
dónde:
(∆V): Es el diferencial de potencial del ánodo con respecto al potencial de protección.
R: La resistencia eléctrica del ánodo.
La resistencia eléctrica del ánodo se calculara con sus características de diseño y fabricación utilizando la siguiente ecuación:
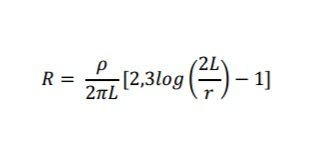
dónde:
R: resistencia del ánodo, en Ohm (Ω)
L: longitud del ánodo, en centímetros (cm)
ρ: resistividad del medio, (Ω.cm)
r: radio equivalente, (cm)
Ya habiendo calculado la resistencia del ánodo se procede a determinar la intensidad anódica teórica. A mayor intensidad de corriente del ánodo, mejor sera su capacidad de protección.
Para realizar el cálculo del
número de ánodos necesarios para proteger determinada estructura metálica, debemos relacionar la intensidad de la corriente total, con la intensidad del ánodo y esto nos permitirá saber el numero de ánodos necesarios.
Cálculo de la intensidad de corriente total del sistema.
La intensidad de la corriente total se determina conociendo el área total de la superficie a proteger, y la densidad de corriente que presenta dicha superficie, esta puede variar de acuerdo a las condiciones del entorno y al tipo de material, existen valores ya tabulados como se muestra en la siguiente imagen:
Densidades de corriente de protección de superficies metálicas en medios agresivos.
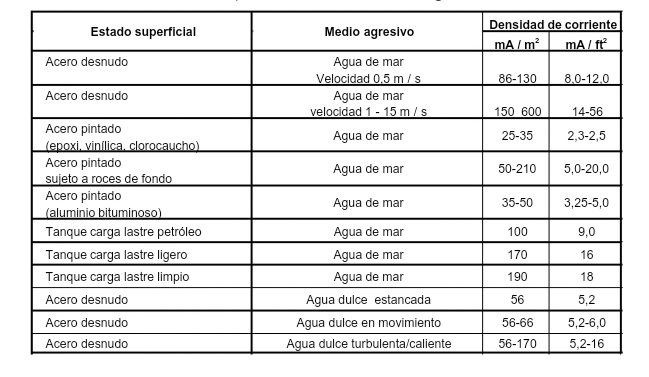
Fuente
Conociendo la densidad de la corriente y el área de la superficie, podemos hacer uso de la siguiente formula, para el cálculo de la intensidad de corriente total.
Intensidad total = dcorriente × área
Cálculo del número de ánodos.
Una vez tenemos los valores de la intensidad total y la intensidad del ánodo, podemos calcular la cantidad de ánodos que sera necesario emplear para proteger determinada superficie metálica. La ecuación para ello, es la siguiente:
N°Ánodos = Itotal ÷ Iánodo
dónde:
N°Ánodos: número de ánodos a utilizar.
Itotal: intensidad de corriente total.
Iánodo: intensidad de corriente del ánodo.
Para una mayor comprensión del uso y aplicación de los ánodos de sacrificio, en la lucha contra la corrosión, les dejo este vídeo en donde se muestra su importancia en la protección de barcos y buques.

.jpeg)
.jpeg)

.jpg)
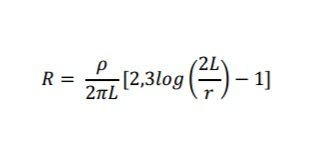


Siendo un SteemStem Estados
Me emociona tanto leer tus post!!! Me recuerdan el por qué uno decide introducirse de cabeza en el mundo de la quimica :$ Saludos!
Me alegra que sientas tanta pasión por la química, me recuerdas a mí cuando estaba empezando a dar mis primeros pasos en esta hermosa ciencia. La química esta mas presente en nuestras vida de lo creemos. Te invitó a seguir indagando en este bonito mundo.
Éxitos y un fuerte abrazo!!!
Es sensacional tu publicación y el nivel técnico adecuado que permite profundizarse en este tema y poder entender el gran aporte que hace la Química a la Industria. Estuve en una oportunidad trabajando en un campo petrolero y habían unos técnicos trabajando en un sector fuera de mi contacto, para un ensayo de protección catodica. En realidad no me dejaron observar a fondo la tarea ya que no pertenecía a ese grupo de trabajo, pero aproveché todo lo pude para satisfacer mi curiosidad. Luego de eso por mi propia cuenta busqué información y tuve la gran suerte que al cabo de un tiempo, participé en un proyecto ambicioso relacionado con todo lo que has explicado. Gracias por renovar mi área de conocimientos en ese sentido. Por otro lado te felicito en dos sentidos: 1) El amplio conocimiento que posees del tema y 2) Tu colaboración al plantear este tema sin mezquindad y con ganas de ayudar que se nota cuando indicas que estás a la orden para cualquier detalle o información. Un saludo cordial.
Me alegran mucho tus palabras, yo siempre he pensado que el conocimiento es universal y por ende debemos compartirlo, el intercambio de ideas genera una retroalimentación que nos hace crecer como profesionales y en el plano personal. La idea de esta publicación era esa transmitir esta información de una manera clara y simple para que los lectores vean la utilidad y aplicación de esta herramienta electroquímica.
Gracias por leer y comentar, saludos!
Muy bien investigado este post. Felicidades
Gracias amiga! Me alegra que te haya gustado. Saludos
Interesante, no sabia de la aplicación de este tipo ánodos.
Gracias jose muy buen aporte, nos sentimos muy felices de tenerte en la comunidad
Gracias Carlos! No sabes como me emociona eso, Uds han sido un gran apoyo.
La ciencia es un mundo fascinante.
Que buena información jose, me gustó mucho y te apoye.....
Otra cosa leyendolo me sentí en clases de Quimica, por lo completo del mismo y lo importante es que entendí todo.
Siendo un SteemStem Estados
Yo sufro con mi carro, ya se le ven ciertas partes oxidadas en la latonería, gracias a que vivo cerca del mar, también algunos muebles de metal en mi casa.
Tus post me recuerdan a las famosas tres Marías del colegio. Muy educativos.
Jajaja... Soy químico mi vida baila al son de una de esas Marías