Complejos con cobre y un poco de química divertida
Saludos estimados amigos de steemit y de #stem-espanol.
Pues bien, los colores en la química no solo son fascinantes sino también informativos, pues nos permiten estimar en base a nuestra percepción la estructura que adquiere determinado compuesto. Y un grupo interesante de compuestos que son muy coloridos los constituyen los complejos de los metales de transición, pues algunos compuestos de estos metales pueden cambiar de color con tan solo cambiar la molécula a la cual están unidos. Quédense a explorar en este post la explicación química detrás de este particular hecho, tomando como ejemplo algunos complejos formados con el cobre cuando se une a ligandos como el amonio, el cloruro y el bromuro. ¡Y aprovechemos este particular fenómeno para hacer un interesante truco!

Compuestos empleados para proporcionar ligandos. Fuente: @emiliomoron, imagen editada en Microsoft Power Point.
Complejos
Comencemos por aclarar a que nos referimos en química con el término complejo, ya que de forma general solemos utilizar el término haciendo alusión a tareas que nos resultan difíciles; pero en química, un complejo se puede definir como el conjunto formado por un átomo o ión metálico unido a un grupo de moléculas o iones mediante enlaces de coordinación, en la cual, el átomo o ión metálico ocupa la posición central y las otras moléculas lo rodean, usualmente estos enlaces de coordinación son más débiles que los enlaces covalentes[1]. A los compuestos metálicos de este tipo se les denominan como compuestos de coordinación, y entre estos, los metales de transición forman compuestos de coordinación con mucha facilidad.
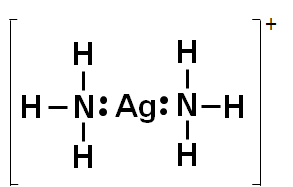
imagen elaborada en Microsoft Power Point por @emiliomoron.
Ligandos
Por otro lado, con el nombre de ligando se denotan a las moléculas o iones que rodean al átomo o ión metálico para formar el complejo. Por lo general, los ligandos son moléculas polares que poseen al menos un par de electrones no enlazados en su estructura. Algunos ligandos comunes se muestran en la siguiente tabla.

Como los iones metálicos, particularmente los iones de los metales de transición, contienen orbitales de valencias desocupados, por lo que pueden actuar como especies aceptores de electrones, es decir, estos puedes comportarse como ácidos de Lewis; mientras que, como los ligandos poseen pares de electrones libres pueden comportarse como bases de Lewis, es decir, pueden actuar como especies donadores de electrones. Tomemos como ejemplo el catión complejo [Ag(NH3)2]+, en el cual hay dos ligandos amino unidos al ión plata, al observar su estructura podremos notar que el complejo resulta de compartir el par de electrones del ligando.
De esta forma, un complejo metálico constituye una especie química que posee propiedades y características diferentes a las del ión central o a la de los ligandos que lo conforman, ejemplo de ello es el color que exhiben; los complejos suelen tener un color muy diferente al del ión metálico o ligandos que lo rodean.
Complejos con cobre (II)
Veamos algunos interesantes ejemplos, utilizando para esta demostración una solución acuosa de sulfato de cúprico. Como les había mencionado en otra publicación (reacciones con sulfato cúprico), el sulfato de cobre (II) pentahidratado (CuSO4.5H2O) corresponde a una molécula compleja, donde el ión cobre se rodea de cuatro ligandos acuo, enlazándose la quinta molécula de agua al grupo sulfato mediante puentes de hidrogeno[2]. Se podría considerar como una coordinación tetraédrica en la cual, los cuatro ligandos acuo que rodean al cobre se ubican en el mismo plano; pero se ubican formando un tetraedro distorsionado producto del efecto Janh-Teller asociado a la deformación de los poliedros de coordinación.
Como el cobre (II) tiene una configuración electrónica que termina en 3d9, dispone esos nueve electrones en dos niveles de energía, según el teorema de Jahn-Teller este sistema experimenta una distorsión al no estar los niveles de energía igualmente ocupados, desestabilizándose los más vacios y adquiriendo el sistema una ganancia de energía[3]. Esta se produce para disminuir la repulsión entre los electrones del ligando y los electrones que ocupan los orbitales del metal, por lo que la distorsión es una forma de estabilizar todo el sistema. En el caso del cobre la distorsión de la simetría octaédrica por un octaedro elongado de forma axial desestabiliza el orbital dz2 ocupado por un solo electrón. Producto de las distorsiones los niveles de energía se desdoblan como se muestra en la siguiente figura.
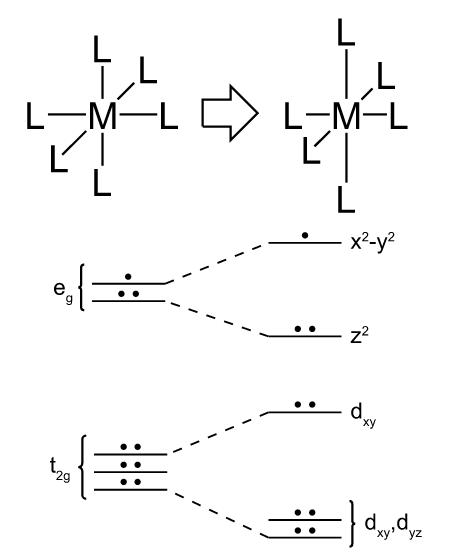
Distorsión en la configuración electrónica producto del efecto Jahn-Teller. Fuente: Wikimedia Commons, imagen con licencia CC-BY-SA-3.0 de Ccoil
El color observado en estos compuestos se debe a las distorsiones y a la ganancia neta de energía para producir la elongación, producto de la interacción eléctrica que generan los ligandos con sus pares electrónicos. Por lo cual, resulta muy sencillo provocar cambios de color en estos compuestos con tan solo sustituir al ligando.
¡Pongamos a prueba esta teoría!
Comencemos la experiencia agregando un poco de sal de mesa (NaCl) a un tubo de ensayo, seguidamente vertimos algunas gotas de una disolución de sulfato cúprico, notaremos que al disolver la sal el color azul de la solución de sulfato cúprico cambia a un tono verdoso.

Color de la solución de sulfato cúprico (izquierda) y de la solución al agregar NaCl (derecha). Fuente: @emiliomoron.
En la disolución, al disociarse los iones cloro se produce el ión complejo tetraclorocuprato (II), CuCl42-. La sustitución de los ligandos acuo por ligandos cloro, que generan campos menos intensos producen absorción de energía en la región azul del espectro, con lo cual el compuesto toma tonos amarillos; pero, por combinación con el azul del complejo acuo, se observa ese tono verdoso en la solución[4]. De forma general la reacción se ilustra como sigue:
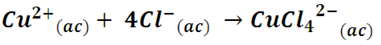
Si ahora, colocamos en el tubo de ensayo un poco de bromuro de sodio (NaBr) al añadir la solución de sulfato cúprico observaremos otro interesante cambio de color. En este caso al disolver el NaBr, se produce la sustitución de los ligandos acuo por ligandos bromo, que aunque son de campos eléctricos menos intensos, produce mayores distorsiones por el efecto estérico producido por la acomodación de un ligando más voluminoso que el cloro[2]. De este modo se produce una absorción de energía por el orden de los 500 nm, con lo cual se exhibe este interesante tono rojo oscuro.

Color de la solución de sulfato cúprico (izquierda) y la solución al añadir NaBr (derecha). Fuente: @emiliomoron.
Si ahora tratamos el sulfato cúprico con solución de amoniaco, observaremos que primeramente se forma un precipitado de color azul verdoso o turquesa, producto de la reacción:
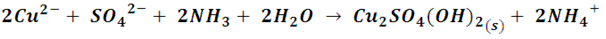
Pero al continuar agregando solución de amoniaco, este precipitado se irá disolviendo y la solución va adquiriendo un tono azul más intenso. Este cambio de color se produce por la incorporación del ligando amino, de campos eléctricos más intensos, lo que produce mayor absorción de energía. La reacción produce el compuesto de coordinación denominado sulfato de tetraamín cobre (II)[5], de acuerdo a la siguiente reacción global:
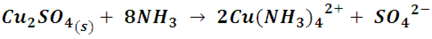
En las siguientes imágenes se destacan los cambios de color al añadir el amoniaco a la solución.

Color de la solución de sulfato cúprico (izquierda), aparición del precipitado al añadir amoniaco (centro) y color al añadir exceso de amoniaco a la solución (derecha). Fuente: @emiliomoron.
Veamos todos estos efectos en el siguente video.
Un poco de magia química
Dado el cambio de color, de un azul muy claro a un azul muy intenso del catión complejo Cu(NH3)42+, se puede utilizar una solución diluida de sulfato cúprico para crear una tinta invisible.
Para ello necesitaremos, además de la solución de sulfato cúprico, solución de amoniaco, una hoja de papel blanco y un palillo de dientes.

Materiales para escribir un mensaje oculto utilizando sulfato cúprico. Fuente: @emiliomoron.
El palillo de dientes lo utilizaremos a modo de pluma, sumergiéndolo en la solución de sulfato cúprico como si lo humedeciéramos en un tintero, y con ello escribiremos un mensaje sobre el papel. Al dejar secar por unos minutos el mensaje desaparece de la hoja, y para hacerlo visible basta con colocar la solución de amoniaco en un envase de vidrio, e introducir esta junto al mensaje en otro recipiente, así los vapores del amoniaco al ponerse en contacto con el sulfato cúprico impregnado en la hoja darán lugar al complejo tetraamin de cobre (II), y su intenso color azul revelaran el mensaje.

Mensaje escrito con sulfato cúprico a la izquierda, mensaje revelado a la derecha. Fuente: @emiliomoron.
Veamos este efecto con el siguiente video.
Aplicaciones de los complejos
También son muy utilizados para realizar valoraciones complejométricas, mediante la cual se puede realizar una titulación estableciendo el punto final de la misma mediante la observación del cambio de color producto de la formación de un complejo metálico, como por ejemplo la determinación de magnesio y calcio en muestras de agua, para establecer la dureza del agua, la cual es causante de incrustaciones por deposición de sales no solubles de calcio y magnesio en las tuberías domésticas y de procesos en la industria.
Los compuestos de coordinación también nos ofrecen una gama de catalizadores muy utilizados a nivel industrial, compuestos formados por complejos de Fe, Ni, Cu y Co, por citar algunos, poseen gran capacidad para coordinar grupos de manera selectiva.
El estudio de los complejos de metales de transición ha abierto el campo de aplicación de la química en otras áreas; como es el caso de la química bioinorganica, la cual, entre sus diversas aplicaciones, se ocupa del estudio del efecto de ciertas moléculas en procesos bioquímicos, como es el caso de la formación de complejos proteicos con metales como el hierro y el magnesio. Con lo cual esta disciplina se encarga de la resolución de problemas ubicados entre las fronteras de otras disciplinas como la medicina, la farmacología y la toxicología[5].
Referencias:
- Wikipedia. Complejo
- Grupo Heurema. Complejos con cobre II
- Wikipedia. Efecto Jahn Teller
- Wikipedia. Cloruro de cobre II
- Wikipedia. Sulfato de tetraamin cobre II
- Lopez, L. (2016). Estudio de complejos metálicos con ligandos de interés biológicos. Tesis doctoral. Unversidad Nacional de la Plata.

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

Qué curioso esto de la tinta invisible. Me pregunto si alguna vez en la historia la han usado esto o algo similar para esconder mensajes 🤔 Puede ser una forma de enseñar didáctica quiímica. Saludos!
Saludos amigo @eniolw. Pues la verdad si, la tinta invisible puede hacerse de diferentes formas, algunas tan sencillas como utilizar jugo de limón, que luego de secar sobre papel se puede revelar con calor, otras son más elaboradas, y según algunos textos que pude consultar leí que su uso está ligado al espionaje (obviamente), por lo que si se ha usado este tipo de técnica, leí que espías estadounidenses y británicos intercambiaban mensajes secretos utilizando una mezcla que contenía sulfato ferroso durante la guerra de la revolución, leí también que la doble agente alemana Mata Hari le fueron incautados diferentes documentos y anotaciones escritos con tinta invisible durante la primera guerra mundial, y con menos precisión encontré que en la antigüedad prisioneros de guerra intercambiaban mensajes escritos con leche, sudor e incluso orina, que luego podían revelar con calor. A veces utilizo información como esta cuando imparto química y si, a los estudiantes les encanta relacionar hechos con la teoría, una vez una joven me dijo “usted parece google” jajaja…
Muy didáctica como presentas la información. Fácil de entender incluso para las personas que no dominamos el área. Te felicito. Me llamó la atención el término bioinorgánico es como contrastante, pero denota que en ciencia nada es aislado y todo está relacionado.
Muchas gracias estimada @endopediatria, me alegra que el contenido puede entenderse por conocedores de otras áreas. Y así es, en este mundo nada queda aislado, ese contraste de dos áreas diferentes nos demuestran como se pueden dar colaboraciones entre distintas ramas científicas para generar nuevos conocimientos e interesantes aplicaciones, que acortan las fronteras que pudiéramos tener concebidas. Gracias por pasar a leer y dejar tu comentario, saludos!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias amigos de entropía!
yo siempre he dicho que yo en otra vida tuve que ser quimico o algo por el estilo hehehe siempre me han gustado este tipo de experimentos porque siempre parece brujeria jajajajaja (sin ofender) me gusta todo el conocimiento que amerita hacerlos, excelente contenido
Saludos estimado @erickyoussif, me alegra que te gusten estos experimentos, bueno la química se deriva de la alquimia, así que en sus inicios era considerada más cosa de magia que de ciencia jajaja. Y bueno, hay muchos fenómenos que ciertamente nos sorprenden tanto como si de magia se tratara. Gracias por pasar a leer y apreciar el contenido!
Decir que me encantó el post, es quedarme corta @emilimoron, en especial el video del mensaje oculto. Esas cosas misteriosas siempre son interesantes, pues uno se imagina viajar en el tiempo en que personas usaban ese método para comunicarse sin ser descubiertos, jajaja.
Saludos Dra. @elvigia, me siento halagado con su comentario, muchas gracias! y me alegra que le gustara. La verdad es que si, cuando uno empieza a leer como y para que se usaron conocimientos como este es inevitable remontarse a esos momentos e imaginarse tal situación jeje. Y según leí aún se sigue usando, por lo que tampoco hay que remontarse mucho en la historia, podemos imaginar situaciones actuales.
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Hola @emiliomoron, me encantó tu publicación, la Química es fascinante, yo podría haberme formado en esta área científica si hubiera tenido experiencias de aprendizaje significativas en el bachillerato, en esa oportunidad debido a la casi nula posibilidad de tener experiencias de laboratorio, no pude visualizar en vivo y directo experiencias tan emocionantes como las que presentas, sólo fuimos evaluados con el conocimiento teórico y analítico, esto último con las fórmulas y nomenclaturas para la obtención de compuestos de acuerdo a la combinación de grupos de elementos de la Tabla Periódica. No obstante, vagamente recuerdo una experiencia con un mechero en el cual observábamos el cambio de color de la llama por el contacto con algún compuesto, los detalles no los recuerdo bien porque hubo una interrupción por un accidente entre dos compañeros y una pipeta con Ácido Clorhídrico. Lo cierto es que al leer tu aporte me di cuenta que las experiencias con la variación de colores es muy pertinente en tú área de experticia como bien dices no sólo como elemento de fascinación sino como indicador en los estudios que realizan los Químicos, lo cual da cuenta de la seriedad e importancia del valioso trabajo que realizan. Estaré más atenta a tus publicaciones, son muy educativas y motivadores para los jóvenes que se interesen por abrazar el estudio de la Química y áreas afines, saludos cordiales!!
Hola @reinaseq, me alegra que te gustara!! Bueno no tengo que decirte que la química me encanta jeje. Y la verdad es esa, muchos jóvenes se enamorarían de esta área de la ciencia si tuvieran experiencias más enriquecedoras en el bachillerato, te aseguro que más jóvenes se verían atraídos por la ciencia, pero en muchos casos los institutos no cuentan con un espacio para desarrollar actividades practicas o el docente, como en tu caso, no ingenia experiencias practicas que se pueden realizar con pocos recursos, aburriendo al estudiante solo con contenido teórico. Y si, aunque nos fascinan, estos cambios de color son informativos en química, precisamente son el indicador de la ocurrencia de algún fenómeno que nos interesa medir. Muchas gracias por pasar por mi blog y dejar tu apreciación que le aporta valor al post, mis saludos.