Alcoholes. Algunas propiedades y usos
Saludos estimados lectores y amigos de las comunidades amantes de la ciencia en habla hispana. En el presente post quiero conversar sobre un tipo de compuesto orgánico de bastante uso y consumo, los alcoholes.

Alcoholes. Edición de @emiliomoron.
¿Qué es en lo primero que pensamos al escuchar el término alcohol, como lo diferenciamos de otros compuestos orgánicos? Quédense a leer para que aclaremos estas preguntas.
Quizás estemos acostumbrados a asociar el término alcohol, con el etanol o alcohol etílico. Es histórico su consumo por medio de bebidas obtenidas a partir de la fermentación de granos, ya que es el constituyente principal de las bebidas alcohólicas, y que han dando pie a su consumo en eventos sociales, y por lo que, de su abuso subyace el término alcoholismo, pues, como droga, son bien conocidos los efectos que tiene sobre el sistema nervioso central. Pero existen numerosas formas de alcohol, y en las farmacias podemos encontrar algunas de ellas, como el metanol y el isopropanol (o alcohol isopropilico), compuestos que se utilizan como antisépticos. Otros alcoholes populares son el mentol, utilizado en las cremas dentales, caramelos y medicinas para dar el sabor a menta y la sensación de frio, y el glicerol, que se utiliza mucho en la industria cosmética. Entonces, si nos hemos dado cuenta, solo por su nombre los podemos identificar por el uso del sufijo “ol” o por el adjetivo alcohol.
Pero los alcoholes son mucho más que el toque mágico de una bebida o lo que nos limpia una herida, que son sus usos más cotidianos, estos son de los compuestos más importantes en la química orgánica, ya que son muy versátiles, se pueden preparar y convertir en muchos tipos diferentes de compuestos. Entonces, químicamente hablando, un alcohol es un compuesto orgánico que contiene el grupo funcional hidroxi (-OH), unido al átomo de carbono de un grupo alquilo o alquilo sustituido, por lo que de forma general se pueden representar con la formula ROH[1].
Estructura química
Como ya les mencione, un alcohol tiene una formula general ROH, la unión entre el grupo alquilo (R) y el grupo OH se da mediante un enlace covalente simple. El grupo R puede estar conformado por un hidrocarburo saturado, sustuido o cualquier otra estructura carbonosa mientras que no posea dobles y triples enlaces u otro grupo funcional más reactivo[1]. Así, para que un compuesto orgánico, de los millones que existen, pueda ser considerado un alcohol el grupo OH debe ser el más reactivo de la molécula, por ejemplo, otro compuesto que tiene el grupo OH es el ácido acético CH3COOH, pero este compuesto tiene dos enlaces reactivos, el enlace C-O y el enlace O-H.

Comparación entre la estructura del metanol y el ácido metanoico. Fuente: @emiliomoron.
Los alcoholes también se clasifican según el tipo de carbono al cual se encuentra unido el grupo OH; si hablamos del etanol, decimos que es un alcohol primario ya que el grupo OH se encuentra unido a un carbono primario, mientras que, cuando se haya unido a un carbono unido a dos grupos R se dice que es un alcohol secundario, de la misma forma, se tendrá un alcohol terciario si el grupo OH se encuentra enlazado a tres grupos R, como se explica con las siguientes estructuras.
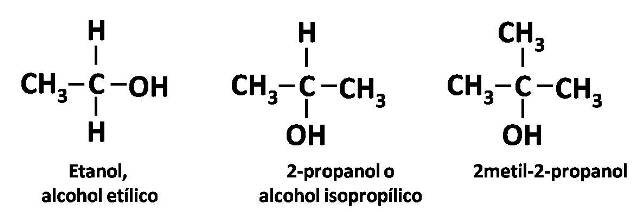
Estructuras de una alcohol 1º, 2º y 3º. Fuente: @emiliomoron.
Esta diferenciación es importante porque no solo influye en la forma en que se nombran los alcoholes, sino también en sus propiedades, incluso dan pie a diferentes reacciones bajo las mismas condiciones.
Pero además, el grupo R no solamente tiene que ser un hidrocarburo de cadena abierta, también pueden ser de cadena cíclica, como el ya mencionado mentol[3], o puede ser un aromático, como el fenol, el cual es un compuesto muy empleado en la preparación de resinas y polimeros[4], pero recibe una consideración aparte.
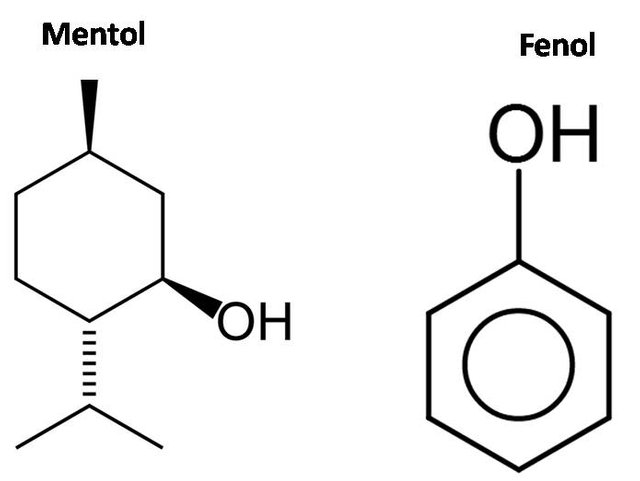
Estructuras de alcoholes con cadenas cíclicas. Fuente: tomado de wikipedia.com y editada por el autor, fuentes originales: mentol y fenol.
Propiedades físicas y químicas de los alcoholes
Polaridad
La electronegatividad del oxígeno es considerablemente más grande en comparación con la del hidrógeno y el carbono, esto tiene como consecuencia que los enlaces covalentes de este grupo funcional están polarizados, de modo que el oxígeno es rico en electrones y tanto el carbono como el hidrógeno tienen baja densidad electrónica[2].
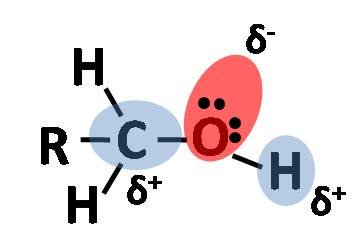
Distribución electrónica de una molécula de alcohol. La zona roja es la región de mayor densidad. Fuente: @emiliomoron.
Densidad
La densidad de los alcoholes, como muchas otras de sus propiedades, aumenta con el número de átomos de carbono y la estructura. En general los alcoholes de cadena lineal son menos densos que el agua, mientras que los alcoholes más ramificados y los que tienen anillos aromáticos son más densos. Una creativa forma de demostrar la densidad de los alcoholes es mediante el efecto de una gota de aceite suspendida en medio del líquido, mostrado en la siguiente figura.
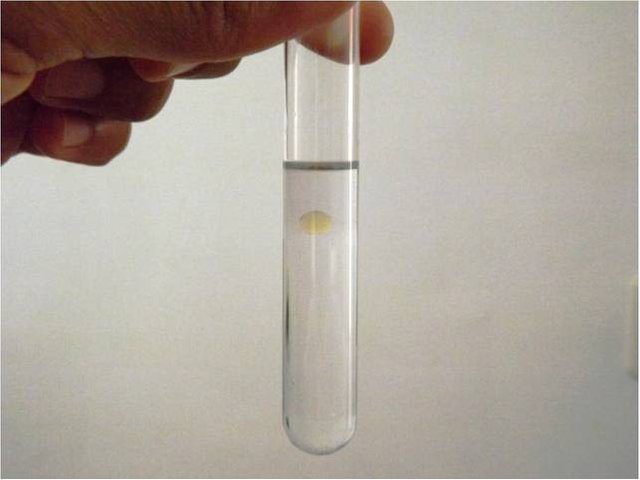
Gota de aceite suspendida en el líquido, efecto de la diferencia de densidad. Fuente: @emiliomoron.
Sorprendente no? El efecto se produce por una diferencia de densidades. Si agregamos un poco de agua en un recipiente, luego colocamos una gota de aceite (con cuidado que no se pegue a las paredes) y sobre este vamos agregando lentamente el alcohol, notaremos que la gota de aceite, que es menos densa que el agua pero más que el aceite, se queda atrapada en medio, de tal manera que n flota ni se hunde.
Caracter anfífilo
Los alcoholes tienen una característica distintiva independientemente de su estructura, su carácter anfífilo. Basta con mirar nuevamente la estructura del etanol, el isopropanol o cualquier otro para notar que el grupo R conforma un hidrocarburo que le da a la molécula un carácter hidrófobo, es decir, que tiene muy poca interacción con el agua.
Pero por otro lado, el grupo -OH tiene la facilidad de formar puentes de hidrogeno con las moléculas de agua, resultando muy afín con estas, por lo que la molécula de alcohol tiene un lado hidrófilo. Lo que quiere decir que los alcoholes tienen un lado que ama el agua y otro que la repele, por lo que se dice que son anfífilos.
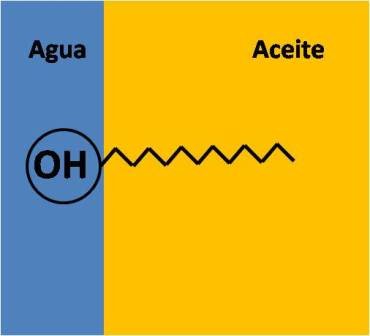
Ejemplo de molécula anfífila. Fuente: @emiliomoron.
Quizás puedan notar que el metanol y el alcohol isopropílico de venta en farmacias son muy solubles en agua, prácticamente se mezclan en cualquier proporción. Sin embargo con alcoholes con cadenas carbonadas más largas la solubilidad decrece.
Inflamabilidad y combustión
Como la mayoría de los compuestos orgánicos, los alcoholes se queman en presencia de oxigeno, produciendo dióxido de carbono y agua, y por la volatilidad que hemos observado en los alcoholes de bajo peso molecular como el metanol, sabemos que son inflamables y se queman con facilidad.

Inflamabilidad de un alcohol. Fuente: @emiliomoron.
Sin embargo la inflamabilidad de los alcoholes disminuye a medida que se incrementa el tamaño y peso de la molécula, ya que a medida que la molécula es más grande existen mayor cantidad de enlaces que se deben romper para producir la combustión, por lo que se requiere de mayor cantidad de energía, por lo que resultan más difíciles de quemar a medida que son más grandes y pesados.
Puntos de ebullición y fusión
Los primero alcoholes de la familia (metanol, etanol, propanol) son líquidos con puntos de ebullición bastante bajos, el metanol tiene un punto de ebullición de 64,5 ºC y el propanol de 97,5ºC[1], apenas por debajo del agua. Pero, así como a media que aumenta el número de átomos de carbono en la cadena aumenta el punto de ebullición, el número de grupos hidroxilo también influye; es así como los dioles (alcoholes con dos o más grupos OH) tienen puntos de ebullición más altos y puntos de fusión más bajo. Un ejemplo de ello es el etilenglicol (HO-CH2CH2-OH), este compuesto tiene alta solubilidad en agua, alto punto de ebullición y bajo punto de congelación, lo que le ha dado un gran uso como refrigerante y anticongelante para vehículos.

Anticongelante y refrigerante para vehículos. Fuente: wikimedia.commons y editada por el autor.
Oxidación moderada
Cuando un alcohol primario se pone en contacto con un agente oxidante como el dicromato de potasio, reaccionan para producir aldehídos, los cuales son oxidados rápidamente a ácidos carboxílicos. En la siguiente imagen podemos observar cómo se sigue la reacción mediante un cambio de color, debido a la reducción del cromo (VII) en la solución naranja a cromo (III), el cual produce ese tono verdoso. La reacción transcurre en medio ácido y con adición de calor.

Oxidación de metanol con dicromato de potasio. Fuente: @emiliomoron.
Los alcoholes actúan como ácidos de Brönsted muy débiles, el valor del pKa se ubica por el orden de 15 a 20, por lo que resultan apenas menos ácidos que el agua[2]. Las diferencias en la acidez de los alcoholes alifáticos en solución acuosa no son muy grandes; y ya que los alcoholes son oxiácidos (OH) las diferencias en las acidez se deben al efecto que tienen los sustituyentes sobre el sitio activo.
En la siguiente figura podemos observar el valor de la constante pKa para varios alcoholes.
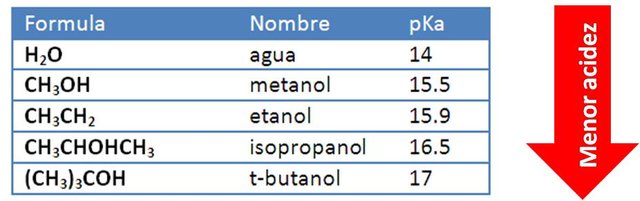
Pka para algunos alcoholes. Fuente: adaptada de chemistrylibretexts.
En la siguiente imagen podemos observar la evaluación de la acidez del metanol cuando se le agrega el indicador de pH naranja de metilo, el color amarillo revela el pH ligeramente ácido.

Evaluación de la acidez del metanol con naranja de metilo. Fuente: @emiliomoron.
Capacidad disolvente
Debido al carácter anfífilo antes explicado, los alcoholes son muy buenos solventes de compuestos grasos. Las grasas son hidrófobas, repelen el agua, por eso resultan difíciles de remover con agua, pero, ya que el grupo R de los alcoholes también tiene esta naturaleza interactúa con las grasas, y como el grupo –OH interactúa con el agua, es fácil desplazar las grasas de una superficie al aplicarle alcohol.
Aplicaciones y usos
Bebidas alcohólicas
Si bien su uso en bebidas alcohólicas no es la principal aplicación de los alcoholes, quizás sea la de mayor conocimiento popular. Las soluciones de etanol, producto de la fermentación de la caña de azúcar, uva y cereales entre otras, mezcladas con otros compuestos que le confieren gratas propiedades al paladar, son el disfrute de muchos en las fiestas y reuniones. Sin embargo el etanol por si solo es nocivo para la salud, creo que hemos escuchado de algunos casos de intoxicación, con resultados lamentables, por la ingesta de bebidas preparadas a partir de alcoholes como los que se venden en farmacias.

Bebidas alcohólicas. Fuente: pxhere.com, licencia CC0.
Antiséptico
En farmacias es muy común que encontremos a la venta alcohol isopropilico al 70% para su uso como antiséptico, el metanol concentrado también es muy usado para este fin. Se aplican en la piel antes de una inyección, en las manos para eliminar gérmenes y también en enjuagues bucales[5].

Alcohol antiséptico de venta en farmacias. Fuente: @emiliomoron.
Combustibles
Los alcoholes se pueden utilizar puros o mezclados con la gasolina en los motores de combustión interna. El metanol se puede utilizar puro y el etanol es mezclado con la gasolina con el propósito de sustituir el contaminante éter metil tert-butílico, o MTBE como también se le conoce.

Estación de combustible dual (etanol y gasolina) en Brasil. Fuente: Mario Duran, licencia CC BY-SA 3.0.
Materia prima de otros productos
Los alcoholes son muy utilizados en la industria química por su versatilidad para producir otros compuestos. Por ejemplo el metanol es utilizado para la producción de metanal, un aldehído muy empleado en la fabricación de plásticos, pinturas y explosivos. A partir del butanol se elabora el butirato de etilo, un éster con olor a piña muy utilizado en la industria alimenticia como saborizante. El vinagre se obtiene por fermentación del alcohol etílico. Alcoholes de cadena lineal larga se emplean como intermediarios para la obtención de polímeros como el PVC y adhesivos[6].
Estos solo son algunas de muchas otras aplicaciones en diversos campos.
Bueno amigos, hasta aquí el presente post, espero que hayan disfrutado el tema y haber contribuido con algo de conocimiento sobre el amplio mundo de los alcoholes ¡Hasta la próxima!
Referencias
1. Morrison y Boyd (1996). Química orgánica. Addison-Wesley Iberoamericana.
2. Chemistry Libre Texts. Properties of alcohol.
3. Wikipedia.com. Mentol.
4. Wikipedia.com. Fenol.
5. Wikipedia.com. Alcohol (medicina).
6. Química organica industrial. Compuestos vinilicos halogenados y oxigenados de ínteres industrial.
Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias equipo de @entropía
Saludos amigo 2eliasches333, disculpa la demora en responder. Muy agradecido por tu apreciciación del post, me alegra que descubrieras cosas nuevas sobre estas sustancias. Respecto al experimento donde se comparan las densidades es solo cualitativo. Saludos y gracias por leer!
Muchas gracias @mosqueteros!
Tenia sólo algunas nociones al respecto. Es bueno tener una perspectiva más amplia tras leer tu post. Felicidades y te invito a usar/seguir-usando la DApp de steemstem.io.
Que tal amigo @eniolw, gracias por pasar a leer, es la idea de compartir este material, ampliar nuestra visión de las sustancias que nos rodean. Por fín logré publicar desde la DApp! seguiré usándola
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Many thanks!
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thank you very much friends