La struttura dell'atomo- I quanti di energia e Bohr
Questo post è la seconda parte di questa rubrica, se vi siete persi la prima parte, vi consiglio di leggerla:

Immagine CC0 creative commons
Rutherford sulla base dei suoi esperimenti ipotizzò per l'atomo una struttura planetaria, questa struttura però portò a diversi problemi secondo le leggi della fisica classica.
Questi problemi furono, però, superati dopo numerosi studi sulla emissione di luce e sulle onde elettromagnetiche in generale.
Per molto tempo si è cercato di definire la natura della luce, ad esempio, Isaac Newton ipotizzò che la luce fosse formata da tante piccole particelle, mentre Christiaan Huygens sostenne che la luce non avesse una natura corpuscolare ma ondulatoria.
Inizialmente grazie anche agli esperimenti sull'interferenza della luce e sull'elettromagnetismo di Maxwell la teoria ondulatoria prevalse, ma alla fine ci pensò Albert Einstein che mise fine a questa "lotta" dicendo che la luce era sia di natura corpuscolare che ondulatoria.
Ma andiamo per gradi...
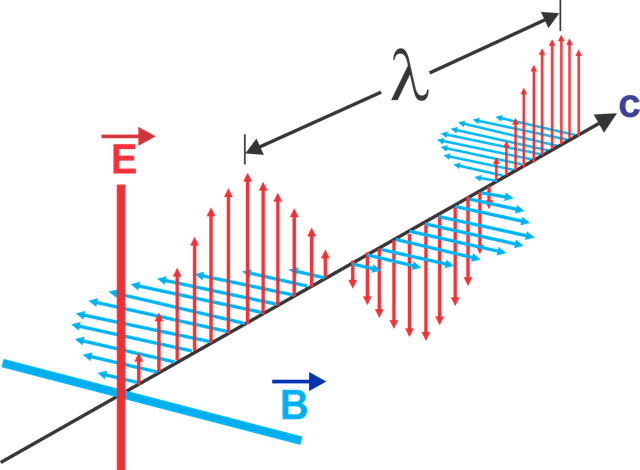
Quali sono i parametri che caratterizzano un'onda?
- frequenza (v) = oscillazioni in una quantità di tempo(Hz)
- lunghezza d'onda (λ) = distanza tra i due punti più alti dell'onda(nm)
- ampiezza (A) = massima altezza della cresta a partire dalla base
- periodo (T) = intervallo si tempo per impiegare un'oscillazione ed è il reciproco della frequenza
- velocità di propagazione = rapporto tra lunghezza d'onda e periodo, se avviene nel vuoto è uguale a
c=3,00*10^{8}
Tutte le onde elettromagnetiche si differenziano per la lunghezza d'onda e per la frequenza d'oscillazione, e l'insieme di tutte queste onde si chiama spettro magnetico.
La luce è una parte molto piccola dello spettro magnetico e rappresenta solo la sua parte visibile ai nostri occhi, e si trova tra l'infrarosso e l'ultravioletto.
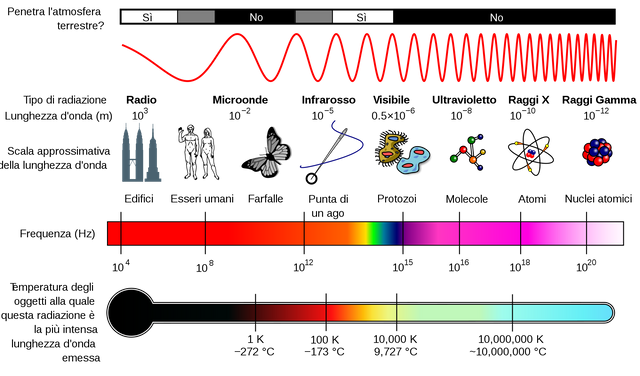
Immagine CC0 creative commons
Teoria quantistica
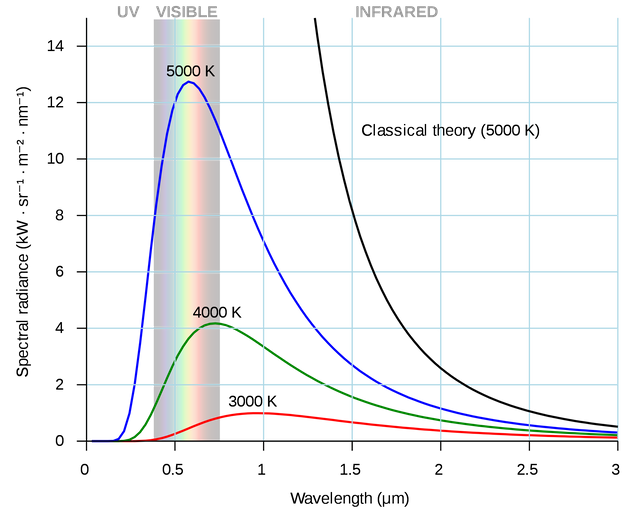
Verso la fine dell'Ottocento vennero scoperti fenomeni, riguardando l'emissione di radiazioni da parte di un corpo nero, dove la fisica classica non riusciva a spiegare.
Il corpo nero è un modello ideale che assorbe tutte le radiazioni che lo colpiscono e rimette per irraggiamento radiazioni la cui lunghezza d'onda dipende solo dalla temperatura del corpo.
In teoria, l'intensità delle radiazioni dovrebbe sempre crescere al diminuire della lunghezza d'onda, ma questo non si verifica.
Nel Novecento il fisico tedesco Plank propose la teoria quantistica rivoluzionando la fisica e tutto il pensiero scientifico.
La teoria quantistica postula che nei processi fisici l'energia non può essere trasferita in modo continuo, ma in quantità ben definite, dette quanti
Per far capire bene questo concetto facciamo un esempio: Per salire un gradino di 20cm bisogna sollevare il piede ad un'altezza di 20cm o superiore, e se il piede viene alzato ad un'altezza inferiore di 20cm non si riuscirà a salire il gradino, si può provare milioni di volte, ma se non si riesce ad alzare il piede di 20 cm, non si salirà mai questo gradino.
In questo esempio l'altezza del gradino si può paragonare al quanto di energia.
Nel 1922 Arthur Holly Compton coniò il termine fotone per indicare un quanto di luce.
Ricapitolando: La luce ha una natura sotto forma di onda ma può avere caratteristiche corpuscolari, ma in che modo questa scoperta diede il colpo finale al modello di Rutherford?
L'atomo di Bohr
Tutti noi conosciamo cosa succede se facciamo passare un fascio di luce attraverso un prisma di vetro, ma ripassare non fa mai male.
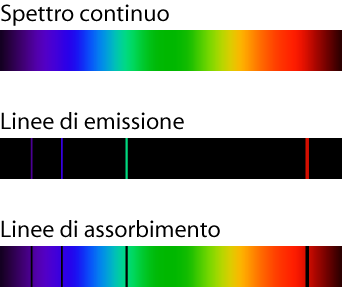
Se si riscalda un gas rarefatto, questo emette luce; e se facciamo passare questa luce, prima tra una fenditura e poi in un prisma di vetro, la luce si scompone in uno spettro luminoso a righe.
Se riscaldiamo un gas compresso otteniamo invece uno spettro di emissione continuo.
Ogni elemento ha un suo spettro di emissione e analizzando uno spettro si può risalire agli elementi che sono presenti.
Nel 1913 Niels Bohr, un fisico danese, ipotizzò che gli spettri fossero collegati al numero di elettroni di elettroni, e unendo la teoria quantistica con il modello planetario dell'atomo, Bohr elaborò il suo modello di atomo basandosi sulle righe di emissione dell'atomo d'idrogeno (l'elemento più semplice), e riuscì anche a calcolare il raggio delle orbite degli elettroni.
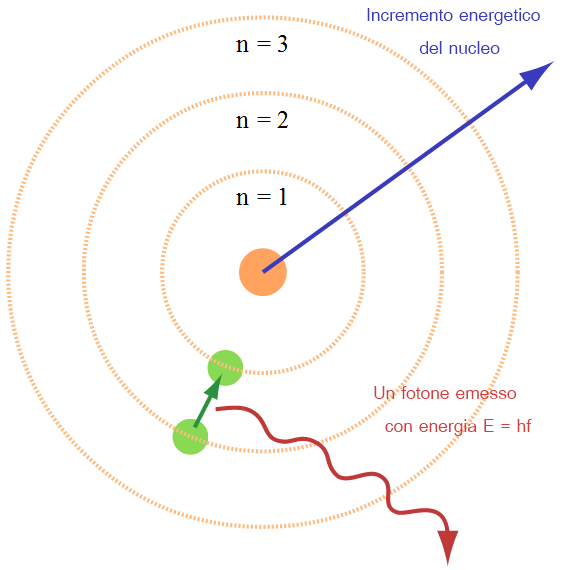
Immagine CC0 creative commons
Con numerosi calcoli Bohr trovò l'espressione per trovare il raggio dell'orbita dell'elettrone:
r=53n^2
Dove n è il numero quantico principale e può assumere tutti i valori da uno a più infinito.
Secondo il modello atomico di Bohr gli elettroni non si distribuiscono in qualsiasi punto intorno al nucleo, ma descrivono orbite poste ad una distanza precisa dal nucleo.
Bohr fece i suoi esperimenti con l'atomo d'idrogeno e notò che se viene fornita energia all'atomo il suo elettrone poteva cambiare orbita, passando dalla più piccola fino a saltare di 3 orbite.
Quando l'elettrone si trova nella suo orbita più piccola si dice che è nello stato fondamentale, quando è nelle altre orbite l'elettrone ha bisogni di più energia ed è in uno stato eccitato.
Normalmente gli elettroni occupano le orbite con raggio minore (minore energia), ma l'assorbimento di energia provoca l'eccitazione dell'atomo, che se è sufficiente comporta il passaggio di orbita, altrimenti l'elettrone rimane fermo.
E' da ricordare però che questa eccitazione è di una durata brevissima (0.8 secondi) e subito dopo avviene la diseccitazione dell'elettrone, che torna allo stato fondamentale.
Il modello dell'atomo di Bohr è perfetto, ma c'è un problema, vale solo per gli atomi idrogenoidi, cioè atomi con un solo elettrone!
E il modello però non spiega neanche perchè avviene la diseccitazione di un elettrone e neanche la frequenza.
Fonti, bibliografia e approfondimenti.
- https://www.focus.it/scienza/scienze/meccanica-quantistica-cosa-e-come-funziona
- https://www.focus.it/scienza/scienze/onde-e-particelle-la-doppia-natura-della-luce
- http://scienzapertutti.infn.it/il-problema-del-corpo-nero
- http://www.chimicamo.org/chimica-fisica/modello-atomico-di-bohr.html
- La nuova chimica di Rippa
Spero che questo post vi sia piaciuto!
Mi scuso che ad ogni post scientifico finisco sempre evidenziando i lati negativi delle varie ipotesi, ma è per creare un po' di suspense, e secondo voi questa volta cosa succederà??

Being A SteemStem Member
Thanks!
hai fatto un post fenomenale! Bravissimo ! Davvero molto bello. The Best......
Ahahah grazie!
MOD!!!
Preciso, analitico e completo. Complimenti!!!
Grazie!
Ammazza sciack, si vede che studi! Tutto ciò spiega come il gatto riusciva a stare sulla tua spalla, elementare direi!
Ahahah grazie! E' anche merito del gatto che è un tipo abbastanza calmo XD.
Fai benissimo ad approfondire queste tematiche! All'università ritornano👍👍
Grazie! Così mi trovo già un passo avanti no?
sciack mod... gran bel lavoro! un saluto @giornalista
Grazie mille! ahaha
Bravo spiegato molto semplicemente
Grazie, ho cercato di semplificare il più possibile.
"1...2...3.. SCIACK e si gira!!" ahaha complimenti, sempre interessanti i tuoi post ;)
Ahahah grazie sono Sciacckato!😂
I'm sorry I was hacked! I have deleted the spam and working on clean up! xo