La struttura dell'atomo dal 700 a Rutherford
La natura elettrica dell'atomo
Fin dal 1700 molti scienziati hanno mostrato interesse per l'elettricità e di tutti i suoi fenomeni, e decisero di studiare in modo molto approfondito questa proprietà della materia.
Il termine elettricità deriva dalla parola elektron che gli antichi greci utilizzavano per spiegare il fenomeno dell'elettrizzazione dell'ambra, per strofinio, con un panno di lana.
Dopo molti anni questo tipo di elettricità venne chiamata elettricità statica, un accumulo di cariche elettriche su un corpo di materiale isolante.
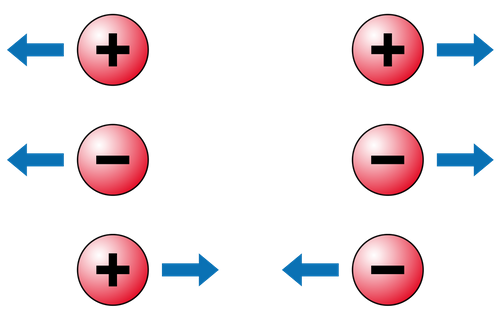
Nel 18° secolo, dopo numerosi esperimenti, si dimostrò che in natura esistevano 2 cariche elettriche: quella positiva e quella negativa. Si notò, poi, che 2 corpi di carica elettrica opposta si attiravano e 2 corpi di carica elttrica uguale si respingevano.
fonte
Nel 1897 un fisico di nome Joseph Jhon Thomson riuscì a identificare gli elettroni, delle particelle di carica elettrica negativa, e circa 2000 volte più piccoli dell'atomo di idrogeno, che a quel tempo era la massa più piccola conosciuta.
Thomson riuscì a trovare l'esistenza degli elettroni utilizzando un macchinario costruito da lui.
fonte
In un tubo, dove è stato creato il vuoto, Thomson applicò una carica una forte differenza di potenziale elettrico tre due elettrodi, il catodo e l'anodo (negativo e positivo). Gli elettroni a questo punto, si liberano dal catodo e si dirigono verso l'anodo.Poi, un campo elettrico devia gli elettroni verso l'alto e un campo magnetico verso il basso.
Con questo metodo si capì che gli elettroni possono rispondere sia a forze elettriche che a forze magnetiche.
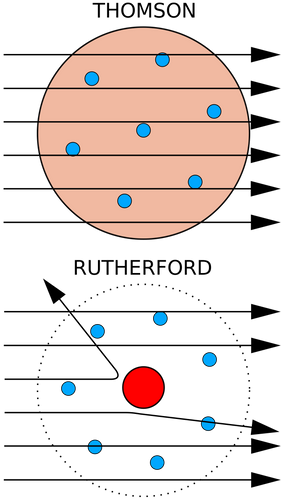
Thomson allora propose il primo modello di atomo, secondo lui, l'atomo era una sferetta caricata positivamente, dove all'interno erano sparsi degli elettroni, in modo da neutralizzare la carica positiva e rendere l'atomo neutro.
Questo modello è detto a panettone, dove i chicchi d'uva rappresentano gli elettrone e la pasta del panettone è la sfera positiva.

fonte
Questo modello rappresentò un grande passo in avanti, ma non era molto convincente.
Per cercare di trovare una soluzione plausibile, entrò in gioco il fisico neozelandese Ernest Rutherford che propose un nuovo modello di atomo.
Rutherford conosceva le proprietà delle sostanze radioattive e aveva scoperto che i corpi radioattivi emettevano raggi ad alta energia e penetranti.
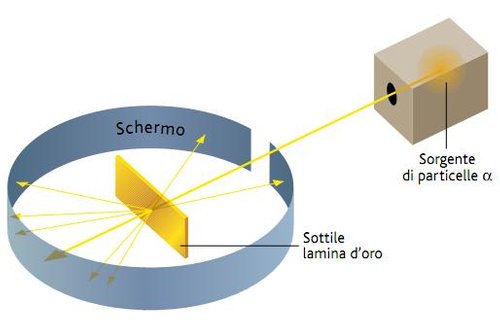
Utilizzando questi materiali Rutherford eseguì un esperimento, uno dei più famosi nella storia delle scienze della materia.
Ecco l'esperimento:
fonte
Rutherford con questo esperimento indirizzò le particelle alfa del polonio (all'interno di un contenitore) verso una lamina d'oro circondata da uno schermo rilevatore.
In teoria queste particelle dovevano attraversare questa lamina sottile 0,0004 mm colpire gli atomi d'oro, con una massa 50 volte superiore ed essere deviate.
La maggior parte delle particelle però attraversarono la lamina normalmente e un piccolo numero di particelle venivano deviate e alcune tornavano indietro.
IL fatto che quasi tutte le particelle attraversassero gli atomi, significava una sola cosa, non avevano incontrato ostacoli.
Ma perché il numero di particelle deviate era così ridotto?
Rutherford allora sulla base dei suoi esperimenti formulò una nuova ipotesi sulla struttura dell'atomo.
L'atomo è formato da un parte centrale, il nucleo, dove è concentrata gran parte della sua massa, e da una parte periferica molto grande e ampia dove sono situati gli elettroni.
Modello dell'atomo di Rutherford e di Thomson a confronto:
fonte
Il nucleo ha carica positiva perchè contiene protoni, la parte periferica ha carica negativa perché ci sono distribuiti gli elettroni, queste due cariche si bilanciano e l'atomo è neutro, questo modello di atomo fu denominato atomo nucleare.
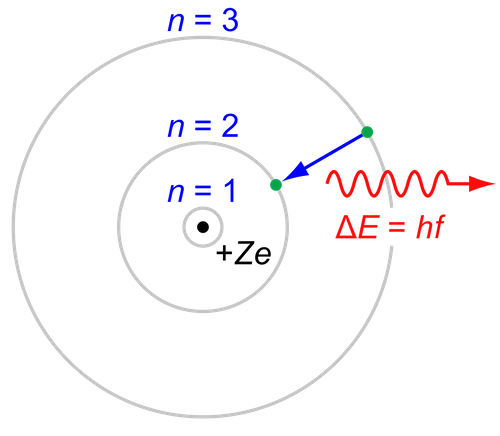
L'atomo secondo Rutherford aveva una struttura planetaria, dove il nucleo rappresentava il sole e gli elettroni i pianeti, che compiono orbite circolari intorno al sole.
Gli elettroni e i protoni hanno cariche opposte e per questo si dovrebbero attrarre, perciò la velocità dell'elettrone doveva creare una forza centripeta capace di bilanciare la forza di attrazione del nucleo.
fonte
Con i suoi dati Rutherford dimostrò che il raggio di un atomo è circa 10 000 volte più grande del raggio del suo nucleo.L'atomo è quasi vuoto.
L'ipotesi di Rutherford però non era del tutto accettabile perché gli elettroni dovrebbero emettere energia per poter continuare a ruotare intorno al nucleo, perdendo energia cinetica perdono anche velocità fino a collassare sul nucleo.

Bibliografia e approfondimenti
Il modello atomico
https://www.matematicamente.it/appunti/chimica-appunti/modello-atomico-thompson-e-modello-atomico-rutherford/
Cos è un atomo? (link eng)
https://www.livescience.com/37206-atom-definition.html
La nuova chimica di Rippa
This is a test comment, notify @kryzsec on discord if there are any errors please.
Being A SteemStem Member
Dopodiché entra in scena Bohr, aspetto la seconda puntata ;)
Esatto, la seconda parte arriverà il prima possibile.
Molto interessante e molto ben scritto. Risulta chiaro e facilmente leggibile!
Resto in attesa anche io della seconda parte ;)
Ok, mi fa piacere! La seconda parte è un po' più complicata ma cercherò di renderla semplice per farla capire a tutti.
Bravo Fra. Apprezzo molto il tuo lavoro 😉.
Grazie 😘
You just planted 2.66 tree(s)!
Thanks to @sciack
We have planted already 7441.26 trees
out of 1,000,000
Let's save and restore Abongphen Highland Forest
in Cameroonian village Kedjom-Keku!
Plant trees with @treeplanter and get paid for it!
My Steem Power = 18429.68
Thanks a lot!
@martin.mikes coordinator of @kedjom-keku