Conozcamos algunas propiedades de los ácidos
En otro post había comentado sobre las características de las bases, por lo que para complementar esa información hoy les quiero hablar sobre su contraparte, la que quizás conocemos mejor o con la cual estamos más familiarizados, los ácidos.
La familia de los ácidos es muy amplia, tenemos conocimiento de ellos porque, a diferencia de las bases, muchos de estos compuestos se identifican genérica o comercialmente con la palabra “ácido”, por ejemplo ácido de batería, ácido ascórbico (vitamina C), ácido acético (vinagre), ácido acetilsalicilico (aspirina), por citar algunos.

El vinagre y las frutas cítricas son ejemplos de algunas fuentes de ácidos en el hogar. Fuente: imagen editada por el autor con imágenes de dominio publico, fuentes originales: vinagre; frutas
Los ácidos son compuestos químicos que tienen como característica principal una capacidad muy grande de ceder protones o de aceptar un par de electrones. Esta característica se deriva de las definiciones más aceptadas de estos compuestos, una de las primeras fue la de Arrhenius, el cual los definió como “un compuesto que contiene hidrógeno y reacciona con agua para formar iones hidronio”[1], el problema de esta definición es que los vincula a un solo solvente, el agua. Una contribución importante para la comprensión de lo que representa un ácido la introdujeron de forma independiente Thomas Lowry y Johhannes Brönsted, considerando ambos que la propiedad responsable de las características de los ácidos era la transferencia de un protón (un ion hidrógeno) de una sustancia a otra, quedando la definición de Brönsted-Lowry como “un ácido es un dador de protones”[1].
Estas definiciones nos permiten tener una idea global de las características químicas de este tipo de compuestos, pero existen muchas sustancias que sin tener hidrogeno en su composición, se comportan como ácidos al neutralizar sustancias con características básicas, por lo que dejan de cumplir con la condición de la transferencia de un protón, por ello, otro concepto fue propuesto por Lewis para describirlas, según su definición un ácido es “una especie química que capaz de aceptar un par de electrones de otra”[2]. Pero la definición de Brönsted-Lowry es la más difundida.
De forma natural podemos reconocer los ácidos por su sabor amargo, en la naturaleza los encontramos en muchas frutas, especialmente las que conocemos como cítricas. Por ejemplo, el ácido cítrico le da su característico sabor al jugo del limón o de la fresa. Y así como nos pasa con estas frutas, mientras mayor sea el grado de acidez que contienen, menor es nuestra capacidad de tolerar el sabor de la misma. Por lo cual, el sentido del gusto nos provee de una forma sensorial de detectar la presencia de los ácidos en los alimentos.
Pero los ácidos no solo se encuentran naturalmente en las frutas, también habremos escuchado sobre los ácidos grasos, los cuales son ácidos orgánicos de largas cadenas carbonadas, presentes en los aceites y grasas. Y de seguro que muchos han experimentado la sensación descrita como acidez estomacal, esa sensación de ardor en la garganta. Bien, el jugo gástrico contenido en nuestro estomago, es una secreción de varias células especializadas y contiene en su composición ácido clorhídrico, además de agua, diversas sales y enzimas[3]; y la sensación de ardor es causada por el reflujo de los alimentos al esófago.
Más allá de las frutas y los alimentos, los ácidos tienen importantes usos, en casa el ácido clorhídrico forma parte de muchos productos de limpieza y quizás el ácido sulfúrico es el ácido con mayor uso industrial, es empleado en la fabricación de agroquímicos, para acidificar pozos petroleros, en la industria metalúrgica se emplea para la limpieza de metales, sin contar que es el electrolito utilizado en las baterías de automóviles.

Batería de plomo ácido. Fuente: pixabay.com
¿Y qué propiedades los hacen diferentes de otras sustancias?
De acuerdo a las definiciones existentes, los ácidos tienen las siguientes propiedades:
• Son capaces de generar iones H3O+
El cloruro de hidrogeno (HCl), el ácido acético (CH3COOH) y el metano (CH4) contienen en su estructura átomos de hidrógeno, pero solo los dos primeros pueden transferirlos a otras sustancias, y en solución liberar iones hidronio, mientras que el metano no lo hace, aunque contiene hidrógeno, este no puede cederse con facilidad.

Una forma conveniente de reconocer un ácido es mediante su formula química, normalmente se escribe el átomo de hidrógeno que puede cederse como el primer elemento de la formula (HCl, HNO3, H2SO4), salvo en los ácidos orgánicos, como el ácido acético, en los cuales se escribe la fórmula para representar mejor al grupo carboxilo (-COOH). De esta forma podremos ver que el metano o el amoníaco (NH3) por ejemplo, no corresponden a formulas de ácidos.
• Tienen hidrógenos con pobre densidad electrónica
En el caso del metano, ninguno de sus átomo de hidrógeno presenta deficiencia electrónica, debido a que la diferencia de electronegatividad entre el átomo de carbono y el hidrógeno no es muy grande, pero si comparamos con una molécula de fluoruro de hidrógeno (HF), la diferencia de electronegatividad entre los átomos de hidrógeno y flúor es tan grande que los electrones pasan más tiempo en la atmosfera electrónica de un átomo que en la del otro, este reparto desigual de electrones resulta en un desplazamiento de la densidad electrónica del hidrógeno al flúor.
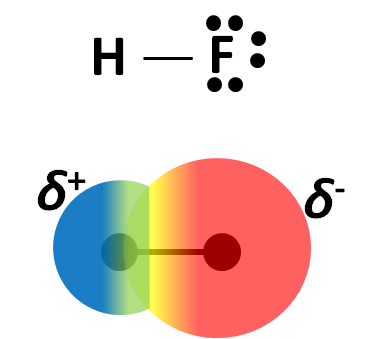
En la imagen se muestra la estructura de Lewis para el ácido fluorhídrico y el mapa de densidad electrónica para la molécula, la región de color rojo es la zona de mayor densidad electrónica. Fuente: @emiliomoron
• Fortaleza y constante de acidez
Los ácidos, así como los electrolitos, se pueden clasificar como fuertes o débiles, esto está relacionado con su capacidad para ceder un protón. En general, se conoce como un ácido fuerte a todos aquellos que pueden disociarse en su totalidad mientras que los ácidos débiles, son todos aquellos que se disocian parcialmente[4]. Y esta capacidad se mide en función de la constante de equilibrio, en el caso de los ácidos conocida mejor como constante de acidez (Ka), la cual es la constante de equilibrio de su reacción con el agua. Los ácidos fuertes, como el ácido clorhídrico, ceden con mucha facilidad protones, por lo que en solución el equilibrio se verá desplazado hacia los productos, sus constantes de equilibrio son tan grandes que se consideran infinitas, es decir, que su reacción es irreversible. En tanto que en los ácidos débiles, ceden con tan poca facilidad protones que sus constante de equilibrio son menores a uno, por ejemplo la Ka del ácido acético es 1,8x10-5[1], y otros tienen valores muchísimo más pequeño, como el ácido cianhídrico (Ka=4,9x10-10)[1]; es decir, el equilibrio de su reacción con el agua se ve desplazado hacia los reactivos. La desprotonación incompleta en los ácidos débiles explica porque presentan un pH mayor que la de un ácido fuerte a la misma concentración. Por lo cual se puede decir que, cuanto mayor es la Ka más fuerte es el ácido.
• Generan pares conjugados
Una vez que los protones de un ácido son cedidos, el ácido se transforma en lo que se conoce como una base conjugada; esto es, una especie química que ahora tiene la capacidad de aceptar protones o ceder un par de electrones. Si observamos la reacción del ácido acético en agua:
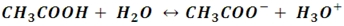
Se puede deducir que el ion CH3COO- resultante tiene ahora la capacidad de aceptar iones H+, lo que lo convierte en una base; y de hecho, es tan buen aceptor de protones que se le cataloga como una base fuerte. En general, los ácido débiles generan bases fuertes y viceversa, los ácidos fuertes generan bases débiles, lo que se define por par conjugado ácido-base.
• Pueden tener cargas positivas
Como les mencioné anteriormente, no todos los ácidos tienen hidrógeno en su composición química, sino que también pueden tener otro tipo de átomo con la capacidad de aceptar electrones.
Consideremos los cationes metálicos como el Na+ o el Cu2+, estos se pueden considerar ácidos, ya que en solución pueden aceptar enlaces de coordinación de especies ricas en electrones. Por ejemplo, en la reacción de iones Na+ con iones OH- para formar hidróxido de sodio:
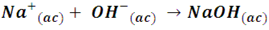
Los iones OH- tienen la capacidad de aceptar protones, por lo cual son bases, y como se puede observar el átomo de oxígeno de esta molécula posee pares de electrones libres, cumpliendo con la definición de base de Lewis, de este modo, los iones Na+ constituyen el ácido en la reacción. Este comportamiento se puede extrapolar a la hidratación del ion Cu2+, cuando se disocia el CuSO4 en agua, cada ion Cu2+ se asocia con seis moléculas de agua para formar el acuo complejo Cu[H2O]2+, de modo que el ion Cu2+ actúa como la especie que acepta un par de electrones, el ácido en este caso.
Así, todas las especies que experimentan este comportamiento se conocen como ácidos de Lewis, mientras que aquellos que donan protones son conocidos como ácidos de Brönsted.
• Sus soluciones tienen valores de pH menores a 7
Por lo que sabemos entonces, una solución ácida contiene una gran cantidad de iones hidronio, así que la acidez de la misma depende de la concentración de este ion en la solución. La escala de pH es el criterio más práctico que han establecido los químicos para establecer la condición de ácido o base de una solución, el pH se define como el logaritmo negativo de la molaridad del ión hidronio:
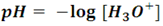
El signo negativo hace que, mientras más grande sea la concentración del ion hidronio menor sea el pH. Específicamente hablando, se considera como ácido a toda solución cuyo pH sea menor a 7 (que es el pH del agua pura).

Escala de pH para la región ácida representando el pH de algunas sustancias comunes. Fuente: tomada de Chemistry Libre Texts, librería con contenido bajo licencia CC BY-NC-SA 3.0, y adaptada por @emiliomoron.
• Neutralizan bases
Los ácidos tienen la propiedad de reaccionar con las bases para formar una sal como producto, por ello estas reacciones se conocen como neutralización, porque mutuamente neutralizan sus propiedades ácidas y básicas.
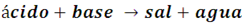
Aunque en general los productos de reacción pueden ser inofensivos, como en la neutralización del ácido clorhídrico con hidróxido de sodio, que produce la sal cloruro de sodio (sal de mesa), en otros casos debemos ser cuidadosos, por ejemplo; en nuestros hogares es común tener limpiadores que son soluciones de ácido clorhídrico (HCl) y algunos que son soluciones de hidróxido de amonio, los vapores de estos compuestos tiene la característica de reaccionar produciendo un nube de cloruro de amonio, según la siguiente reacción:
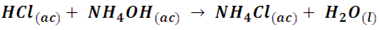
El cloruro de amonio forma una nube tóxica que puede producir irritación de las vías respiratorias.
Consideraciones finales
Los ácidos tienen grandes aplicaciones a nivel industrial e igualmente tienen múltiples aplicaciones en nuestra vida cotidiana. Su aplicación depende de sus características, pero siempre debemos tener las debidas precauciones al utilizarlos, bien sea como ácidos concentrados o como sus soluciones, las cuales se usan en los limpiadores domésticos.
Cuando se indica que los ácidos tienen un sabor amargo, es siempre que su concentración sea lo suficientemente baja como para no dañar irremediablemente los tejidos de la lengua, pues debemos recordar que también son bastante corrosivos.
En este momento todos hemos oído hablar de la lluvia ácida, y sus efectos. Esta se produce por la reacción de óxidos no metálicos como el SO2, NO además del CO2 con el agua, formando ácido sulfúrico, ácido nítrico y ácido carbónico; lo que le confiere al agua de lluvia un pH cercano a 6, con lo que es capaz de causar severos daños en los bosques y deteriorar estatuas y ornamentos de edificaciones que estén fabricados de mármol o piedra caliza.

Daños causados por la lluvia ácida en una gárgola y sobre los árboles de un bosque. Fuente de las imagenes: gárgola, por Nino Barbieri, bajo licencia CC BY-SA 3.0, bosque, por Lovecz, compartida como imagen de dominio público
Por todo ello, conocer las características y propiedades de los ácidos resulta importante para comprender el modo en el que reaccionan con otras sustancias y los efectos que estos pueden tener sobre un sistema, una persona o el ambiente.
Referencias:
- Atkins, P., Jones, L. (2006). Principios de química. Editorial Médica Panamericana S.A.
- Chang, R. (2002). Química. Editorial McGraw-Hill.
- Wikipedia.com. Jugo gástrico
- Wikipedia.com. Ácido

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
thank you very much for the constant support friends!
This post was shared in the #spanish-curation channel in the Curation Collective Discord community for curators, and upvoted and resteemed by the @c-squared community account after manual review.
@c-squared runs a community witness. Please consider using one of your witness votes on us here
Muchisimas gracias por el apoyo estimada comunidad de @c-squared
Gracias por el apoyo @don.quijote!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Muchas gracias equipo @entropia!
¡Felicidades! Esta publicación obtuvo upvote y fue compartido por @la-colmena, un proyecto de Curación Manual para la comunidad hispana de Steemit que cuenta con el respaldo de @curie.
Si te gusta el trabajo que hacemos, te invitamos a darle tu voto a este comentario y a votar como testigo por Curie.
Si quieres saber más sobre nuestro proyecto, acompáñanos en Discord: La Colmena.
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
many thanks friends!
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board
If you no longer want to receive notifications, reply to this comment with the word
STOPEncantada con tu publicación @emiliomoron, con gran destreza nos paseaste por los ácidos contenidos en los alimentos que consumimos; en los efectos que estos pueden producir en los tejidos con los cuales tienen contacto, la importancia de los ácidos de los jugos gástricos que son importantes en la digestión de los alimentos; pero que también pueden causar daño, tal es el caso del reflujo gastroesofágico y el extraesofágico.
Es de resaltar el cuidado que debemos tener con los ácidos que manipulamos en las labores domésticas; además de nunca dejarlos al alcance de los niños, por el riesgo de envenenamiento y quemaduras, que pueden ocasionar la muerte. Muy buen artículo, felicitaciones!
Saludos Dra. @elvigia, muchas gracias! me alegra que le haya gustado. Debemos resaltar el cuidado con los productos de limpieza, sobre todo evitar combinarlos sin conocer el tipo de reacción que pueden generar, y hay que tener especial cuidado de no dejarlos al alcance de los niños, a veces nos pasamos de confiados por pensar que son productos de uso doméstico, pero no dejan de representar un gran riesgo para la salud así tengan una baja concentración. Muchas gracias por pasar a leer Dra!
Hola @emiliomoron, muy bueno tu aporte sobre los ácidos, es cierto cuando afirmas que muchos de estos forman parte de nuestra cotidianidad en tanto que se encuentran en muchos alimentos como las frutas, cuyo consumo se nos recomienda para fortalecer nuestro sistema inmunológico, entre otros beneficios, sin embargo, en los que no son necesariamente alimenticios el ser humano tiende a tener cuidados exclusivos porque en general se entiende que puede ser peligroso el manejo de ciertos ácidos, aunque no con los excelentes detalles que describes en tu publicación. Por otro lado, preocupa la forma como ciertos ácidos pueden ser adquiridos por las personas, esto lo menciono porque se ha visto en las noticias como por accidente o de manera intencional debido a diatribas de índole personal, alguien arroja ácidos sobre una persona y se observa que los efectos son devastadores e irreversibles, en este sentido, debería haber un llamado a la conciencia en principio y a que se manejen ciertas restricciones en la venta de productos tan dañinos, salvo casos plenamente justificados como estudios científicos y que éstos no ocasionarán daños a terceros. Tu publicación es muy importante, creo que debemos conocer mucho más sobre los ácidos por el bienestar individual y colectivo, saludos fraternos y éxitos!!
Hola @reinaseq, mis mejores saludos y un abrazo! muchas gracias por pasar a leer mi publicación. Ciertamente los ácidos están en todos lados, en alimentos y productos de limpieza, en estos su concentración es bastante baja y con el debido cuidado no deben representar un gran riesgo, sin embargo, ciertamente hay muchos ácidos concentrados que se pueden encontrar comercialmente con casi ninguna restricción de venta, por ejemplo el ácido sulfúrico, para que nuestro laboratorio realice una compra de este reactivo debe cumplir con una serie de permisos y tramites, pero el ácido de batería también es ácido sulfúrico concentrado, y lo puedes encontrar en muchas tiendas de repuestos y comercios y adquirirlo sin problema. Tienes razón en cuanto al llamado a la conciencia para evitar su uso de forma indebida. Muy agradecido por tu comentario @reinaseq, nos seguimos leyendo.