Estudio, preparación y propiedades de: H2, O2, O3, H2O y H2O2
Saludos estimada comunidad de #Steemit y en especial a la comunidad científica de #Stem-espanol. Con ánimos de mostrarles algunas propiedades y caracteristica de dos de los elementos mas relevantes y de mayor proporción en nuestro planeta les comparto este post sobre el oxigeno e hidrógeno
Introducción
El hidrógeno es el elemento número 1 de la tabla periódica, que se encuentra en el ambiente como una molécula diatómica formada por dos átomos, su característica es que es la más liviana de todas las moléculas gaseosas; a la temperatura ambiente es un gas sin color, sin olor, insípido y sumamente inflamable. En un laboratorio científico se puede obtener hidrógeno al hacer reaccionar ácidos con metales como el zinc. Este elemento reacciona directamente con otros elementos oxidantes, en algunos casos son reacciones espontanea que producen agua o también reacciona explosivamente con los halógenos en ciertas condiciones.
El uso del hidrógeno empezó a principios del siglo veinte para llenar globos aerostáticos. En la actualidad industrialmente se utiliza para fabricar amoniaco, y en la síntesis de alcohol metílico, también en la hidrogenación de grasas vegetales y para producir grasas comestibles.

Por otra parte el oxigeno es el elemento de mayor proporción en la tierra, este presenta acusadas propiedades oxidantes. Para obtenerlo en un laboratorio se emplea a licuación del aire y destilación fraccionada del mismo o una electrolisis del agua, descomposición catalítica de (H2O2) debido a que este es inestable y se descompone fácilmente a oxígeno y agua con liberación de calor, aunque no es inflamable, también representa un agente oxidante potente que puede causar combustión espontánea.
El oxígeno es empleado para la síntesis de muchas sustancias químicas, como el ácido sulfúrico y el acetileno. Se utiliza también en líquido como combustible de cohetes y misiles para la fabricación de explosivos y en medicina se aplica para pacientes con problemas respiratorios como ya todos conocemos. El Ozono es una forma molecular constituida por 3 átomos de oxígeno, cuya presencia en la atmósfera es proteger la tierra de la incidencia de radiación ultravioleta procedente del sol. Estos dos elementos se combinan formando moléculas, que conocemos como agua y peróxido de hidrógeno.
El objetivo de este post consiste en caracterizar las propiedades de los elementos del grupo 1 (IA) a través de métodos de laboratorio sencillos y muy demostrativos.
Parte Experimental y Resultados Obtenidos.
Producción de Hidrógeno.
Procedimiento
Se realizó el montaje del equipo para obtener hidrógeno gaseoso (Figura 2), el cual consto de un cilindro graduado lleno de agua invertido en un beaker, introduciendo un extremo de una manguera dentro del cilindro y el otro extremo se conecto a un matraz dispuesto de de un tapón, al matraz se le añadió una porción de zinc granulado y una solución de ácido clorhídrico diluido, observando así la producción de hidrógeno gaseoso.
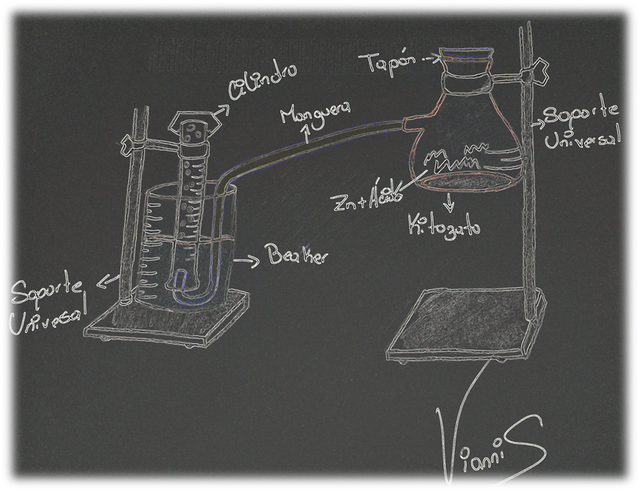
Figura 2.- Equipo para producir hidrógeno. Fuente: @VianniS
A medida que transcurrió la reacción la cantidad de zinc disminuyo quedando entonces cloruro de zinc (ZnCl2). La reacción que ocurre entre el zinc y el ácido clorhídrico diluido es [1]:

La acción de algunos metales en soluciones ácidas dan como resultado la oxidación del metal y la reducción del hidrógeno que es liberado en forma gaseosa. Se deduce que la ecuación [1] es una reacción oxido-reducción, en donde el potencial de celda positivo (E0 Celda) y el ∆G nos indica que la reacción se produce de manera espontánea.
Combustión del Hidrógeno
Procedimiento
Se colocaron en un matraz Erlenmeyer de 250 mL unos 10 mL de H2SO4 6M, que se tapó empleando un tapón monohoradado, a través del cual se insertó un tubo de desprendimiento de gases, quien tiene una forma de “L” (ver Figura 3), como también se agregaron unos gránulos de Zn tapando rápidamente, por otra parte se encendió una llama, la cual se acercó a la boca del tubo para notar así la presencia del combustible.
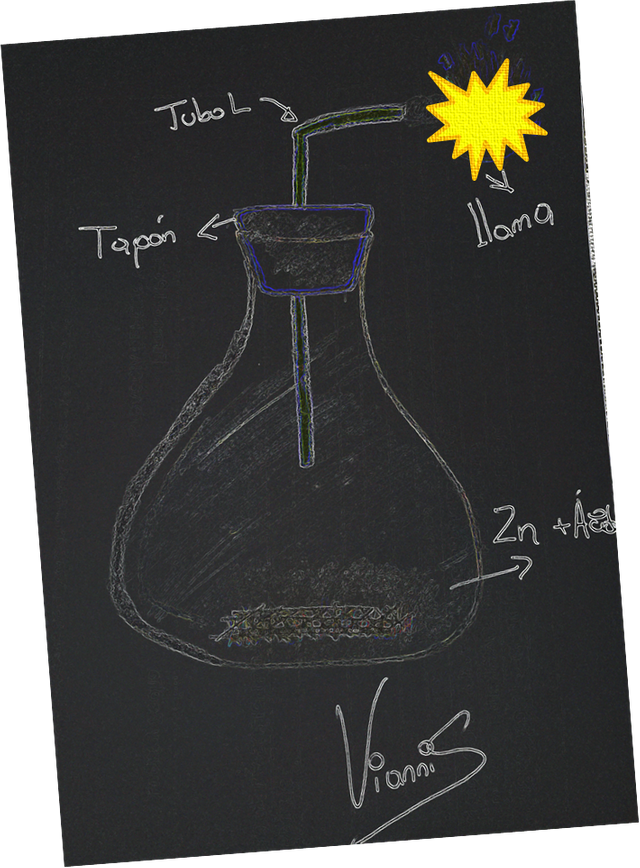
Figura 3.- Equipo para la combustión de hidrógeno- Fuente: @VianniS
La presencia de hidrógeno se comprobó al acercar la llama de un encendedor a los gases producidos en el sistema, observándose así el crecimiento de la llama causado por la liberación del gas. El proceso de combustión liberó energía calórica y ésta elevó la temperatura en los productos; la temperatura alcanzada dependió de la velocidad de liberación y disipación de energía, así como de la cantidad de productos de combustión.
Al mezclar dos volúmenes de hidrógeno con un volumen de oxigeno se obtiene un detonante. Al encender la mezcla de gases reaccionan con explosión; cabe señalar que si en la mezcla las proporciones son de 6 a 67% de hidrógeno, esta explotará al encenderla. Por lo cual al comprobar el poder explosivo que posee este pequeño elemento, luego de la procedencia de formación del mismo por el ácido diluido y el zinc como metal reductor se manifiesta la formación de agua en el proceso de combustión, la que se condenso en las paredes del tubo, esto indica que realmente el hidrógeno es explosivo bajo la presencia de compuestos combustibles, según la teoría se confirma el carácter espontaneo de la formación de agua a partir de hidrógeno y oxigeno diatomico, en presencia de una fuente de energía.
Poder Reductor de Hidrogeno.
Procedimiento
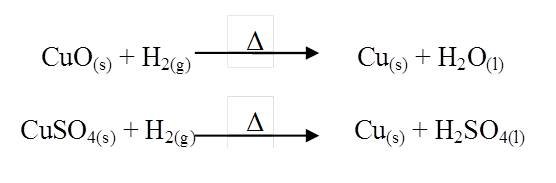
Se empleó el procedimiento anterior para producir hidrógeno, en este caso el extremo de la manguera se conecto a un tubo de reducción donde se coloco en el primer ensanchamiento oxido de cobre (CuO) y en segundo sulfato de cobre (CuSO4), se calentó el tubo de reducción con un mechero, pasando la corriente de hidrógeno a través tubo.
La reacción de reducción del zinc sobre el ácido clorhídrico diluido, no se pudo observar ningún cambio; debido a esto, se empleó ácido concentrado para producir hidrógeno más rápidamente, y que así reaccionara con los compuestos justo al momento en que se apaga la llama del mechero, dicha modificación de la experiencia tampoco logro un cambio. Las reacciones que debieron suceder son las siguientes:
Producción de Oxígeno.
Procedimiento
Se realizó el montaje de un equipo para la obtención de oxígeno (como se muestra en la figura 4), donde se sujetó un matraz Erlenmeyer a un soporte universal, a este se le añadieron cantidades necesarias de permanganato de potasio (KMnO4) y dióxido de manganeso (MnO2), para luego tapar con un tapón monohorado, al cual se le incorporo un tubo de desprendimiento donde su extremo inferior fue colocado en el cilindro graduado, que se encontraba sujetado de forma invertida en un segundo soporte, teniendo como base una especie de cuba o envase lleno de agua del grifo, Seguidamente con ayuda de una plancha de calentamiento se calentó el matraz, para obtener oxígeno por descomposición del permanganato de potasio, lo que se comprobó mediante las pruebas de oxidación de sodio (Na) y azufre (S), explicadas en el siguiente punto.
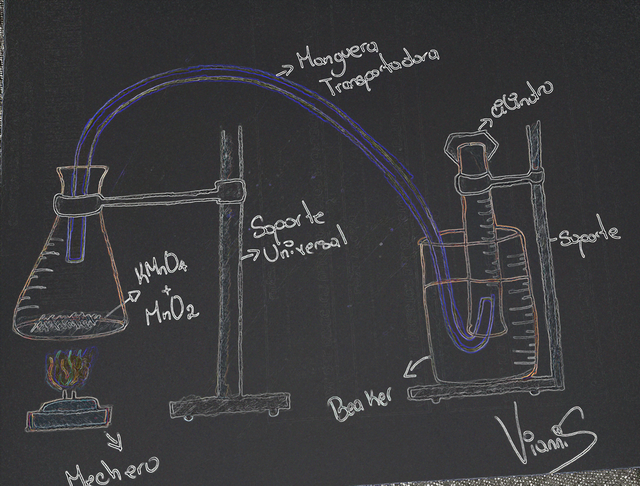
Figura 4.- Equipo para producir oxígeno-Fuente: @VianniS
Según la parte experimental antes mencionada, y empleando el equipo adecuado se obtuvo oxigeno por descomposición térmica del permanganato de potasio (KMnO4). Dicho procedimiento se puede explicar mediante la siguiente reacción que propone [2]:
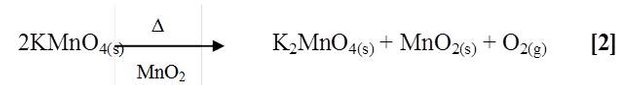
La reacción de descomposición del permanganato no es espontánea y depende de la aplicación de calor para aumentar la energía cinética de las moléculas y permitir la formación del oxígeno de manganato de potasio y dióxido de manganeso, todo esto debido a la reducción del ion permanganato.
Poder Oxidante del Oxígeno.
Procedimiento
Para comprobar el gran poder oxidante del oxígeno se recurrió a unas pruebas, en las cuales se usó azufre (S) y sodio (Na) encendido, estos se pasaron por la corriente de oxigeno observando en el sodio una coloración amarilla en el sólido que demuestra la presencia del (Na2O) y en el caso del azufre se pudo visualizar el desprendimiento de un gas, el cual resulto (SO2).
Según la literatura, el sodio al estar en contacto con el oxígeno se oxida rápidamente debido a su elevada reactividad; dicha reactividad viene dada por su baja energía de ionización que deriva en una gran tendencia a perder su único electrón de valencia característico en todos los metales alcalinos. Esta reacción [3] da como producto oxido de sodio y peróxido de sodio este en menor proporción, todo esto se debe a la reducción del oxígeno.
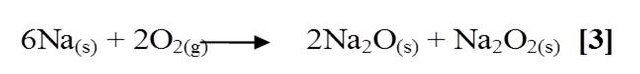
El azufre fundido al estar en contacto con el oxígeno entra en combustión liberando una llama de color azul, dicha reacción es de combinación [4] en la que ocurre una rápida oxidación del azufre formándose dióxido de azufre, un gas muy peligroso y de olor asfixiante.

Prueba de Cualitativas del agua. Iones Sulfato (SO4-2) y Cloruro (Cl-)
Procedimiento
Se colocaron 4 Erlenmeyer con 25mL de agua, dos de ellos con agua de grifo y los otros con agua destilada, a los mismos se realizó la prueba de control empleando cloruro de bario (BaCl2) y nitrato de plata (AgNO3).
Dicha prueba consto en añadir en el caso del ion cloruro (Cl-), una disolución de nitrato de plata (AgNO3) y una porción de cloruro de sodio (NaCl), observando un precipitado blanco grisáceo según la reacción [5], y en el ion sulfato (SO4-2), una disolución de cloruro de bario (BaCl2) y una porción de sulfato de sodio (Na2SO4), quedando un precipitado blanco cuya reacción [6] indica su presencia.
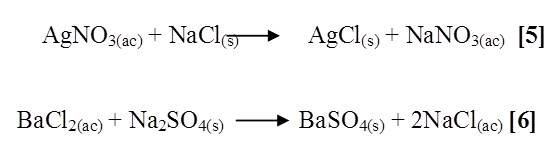
A los otros 2 Erlenmeyer restantes se le agrego agua de grifo, aplicando las pruebas anteriores empleando nitrato de plata (AgNO3) y cloruro de bario (BaCl2), dichas pruebas fueron satisfactorias debido a la presencia de los iones en el agua de grifo.
Reacciones con Peróxido de Hidrógeno
Procedimiento
En una gradilla se colocaron seis tubos de ensayo, a los cuales se les adicionaron 2 ml de peróxido de hidrógeno (H2O2) al 3%. A cada tubo se le incorporaron con la ayuda de una espátula reactantes diferentes, tales como: yoduro de potasio (KI) en medio neutro y ácido, permanganato de potasio (KMnO4) en medio ácido , sulfato de plomo (PbS), oxido de mercurio (HgO) en polvo con dos gotas de amoniaco (NH3) y al último tubo de ensayo dióxido de manganeso (MnO2). Para los compuestos en medio ácido se adicionaron al tubo de ensayo correspondiente tres gotas de ácido clorhídrico concentrado.
- Reacción con Yoduro de Potasio (KI) en medio neutro y ácido.
En medio neutro: se añadió a un tubo de ensayo unos mililitros de peróxido de hidrógeno (H2O2), y seguidamente una pequeña porción de yoduro de potasio (KI), al agitarlos se observo una efervescencia inmediata de color amarillo anaranjado debido a la formación del yodo en medio básico y burbujas que señalaron la formación de oxígeno gaseoso que se indica en la siguiente reacción [7]:
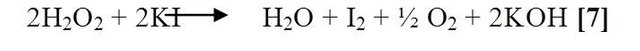
En medio ácido: se utilizo el procedimiento anterior pero en este caso se empleo ácido clorhídrico para acidificar el medio, dando como resultado una turbidez de color ámbar debido a la reacción moderadamente rápida que ocurría, donde la presencia de tal color se debió a la formación de yodo en medio de la sal producida, cuya reacción es la siguiente [8]:
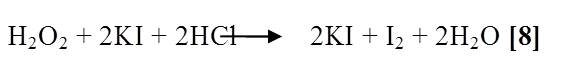
2 Reacción con Permanganato de Potasio (KMnO4) en medio ácido.
Se agrego a un tubo de ensayo una pequeña cantidad de permanganato de potasio (KMnO4) y unos mililitros de ácido clorhídrico (HCl) 2M, se observo un desprendimiento de gas que es debido a que el KMnO4 oxido al ácido clorhídrico, dicha oxidación se expresa en la siguiente reacción [9]:
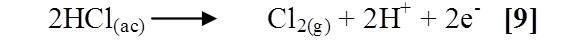
Al añadir a la reacción el peróxido de hidrógeno (H2O2) se visualizó un cambio de color de los reactivos a un morado oscuro muy intenso y un nuevo desprendimiento de gas. Esto es consecuencia que en presencia de un oxidante mas fuerte como el permanganato de potasio, el peróxido de hidrógeno se comporta como reductor y provoca el cambio de iones permanganato en medio acuoso y un precipitado de dióxido de manganeso (MnO2), disminuyendo su estado de oxidación [10].
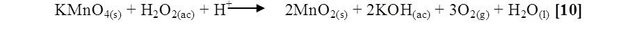
3 Reacción con Sulfuro de Plomo (PbS)
Al adicionar el peróxido de hidrógeno al tubo de ensayo que contenía el sólido del sulfuro de plomo (PbS), se observo que la solución permaneció incolora y se formo un pequeño precipitado. Así mismo, hubo un desprendimiento de gas.
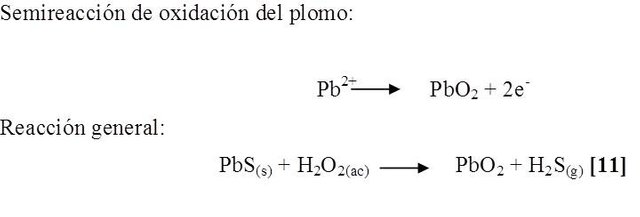
Según la literatura, este desprendimiento correspondió a la formación de sulfuro de hidrógeno en el medio y, como se podrá demostrar en la siguiente reacción [11], el peróxido de hidrógeno se comporto como un agente oxidante, aumentando el estado de oxidación del plomo de +2 a +4 y contribuyendo a la formación del óxido de plomo (IV).
4 Reacción con Oxido de Mercurio (HgO) + gotas de Amoniaco (NH3)
Al añadir el oxido de mercurio (HgO) al tubo con peróxido de hidrogeno (H2O2) no reacciono, seguidamente se le adiciono una gotas de solución amoniacal, observando así una efervescencia en el tubo y la solución se torno blanca lo cual es característico en la formación de hidróxido de amonio en la solución. Esto se demuestra en la siguiente reacción [12]:

5 Reacción con Dióxido de Manganeso (MnO2)
La última experiencia fue adicionar en este caso dióxido de manganeso (MnO2) al peróxido de hidrogeno (H2O2) contenido en el tubo de ensayo, dicha reacción produjo abundante efervescencia que indico el desprendimiento del oxígeno liberado, esto se debe a la reacción de descomposición que experimento el peróxido de hidrógeno en contacto con el dióxido de manganeso, el cual se comporto como catalizador, acelerando la cinética de dismutación de este compuesto.
Reacción de dismutación catalítica de este compuesto [13]:
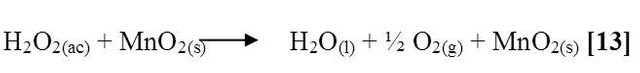
En general, observando todas las reacciones estudiadas anteriormente se presenta que el peróxido de hidrogeno puede actuar como agente oxidante o reductor; el comportamiento de este depende del medio en el cual este presente el compuesto.
Disposiciones finales
En esta oportunidad se estudiaron, la preparación y propiedades de distintos compuestos que comprendían la existencia ya sea de hidrógeno u oxígeno en su estructura química tales como: H2, O2, H2O y H2O2; a dichos compuestos se les aplicaron diferentes pruebas, en el caso del hidrogeno y oxigeno su obtención y combustión, así como; su gran poder reductor u oxidante. Se logró observar la presencia de iones cloruro y sulfato en las pruebas cualitativas realizadas al agua, también se comprobó que el peróxido de hidrogeno puede actuar como agente oxidante o reductor de acuerdo al medio en el que se utilice, en base a lo expuesto en la literatura fue posible la discusión y análisis químico de las observaciones de cada experiencia.
Espero que les haya nutrido de conocimiento científico. Y si quieren seguir leyendo contenido de calidad e interactuar con científicos, médicos e ingenieros de diferentes áreas les extiendo la invitación a nuestro canal de Discord de la comunidad científica #Stem-espanol
Nota Las fotos de los sistemas fueron tomadas de mi cuaderno de laboratorio. :D
Referencias Bibliográficas.
- Odetti, H. y Bottani E. 2006. Introducción a la Química Inorgánica. 3ra Edición. Ediciones UNL. Universidad Nacional del Litoral. Santa Fe, Argentina.
- Raymond Chang, Química General, 5ta edición, editorial Mc Graw Hill, Pág. 138 -820.
- Fisicoquímica volumen 1 Ira N. Levine editorial Mc Graw Hill. Pág. 142-168
- Cotton, F. Albert, Wilkinson, Geoffrey “Química Inorgánica Avanzada”. Primera Edición. Editorial Limusa. México DF 2005. Pág. 209
- Sienko, M, Plane, R. Química. Primera Edición en Español. Ediciones Aguilar. España 1970.
- Skoog and West Química Analítica. Editorial Prentice Hall.
- Rayner-Canham, G. Química Inorgánica Descriptiva. Segunda edición, Editorial Pearson. México 2000.
¡Felicitaciones!
Estas participando para optar a la mención especial, que se efectuará el 26 de Agosto del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Graciiias por el apoyo constante.
Graciiias por el apoyo constante.
Buen trabajo @viannis. Muy didáctica y esquematizada la explicación. Saludos.
Gracias por leerme siempre estimada. saludos
Excelente artículo, el que nos presentas estimada @viannis
Gracias por leerme.
Saludos @viannis excelente trabajo !
Gracias estimado. saludos
Saludos @viannis. Chequea la publicación, no se cargó más nada luego del primer párrafo de la introducción
Saludos querido @emiliomoron gracias por informarme. Ya corregi el error
De nada @viannis, para eso estamos. Muy buena la información que nos traes y la presentación de los sistemas, éxito!
Saludos @viannis. Excelente trabajo el que nos traes. Una impecable didáctica y presentación. Me encantaron tus figuras. Mis felicitaciones.
Profesor gracias por estar pendiente de mis post semanales. Saludos
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Thanks for the support. Good job
Hi @viannis!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thanks fot support me.
Felicitaciones Excelente trabajo de Investigacion. Saludos
Querida @aisquels Gracias por disfrutar de mis humildes trabajos.
Como dice un amigo: "Más claro imposible". Excelente contenido y la forma de expresarte muy buena para todos aquellos que no entiendan mucho puedan comprenderte. Genial las imagenes.
Gracias amigo @hogarcosmico por leer frecuentemente mis publicaciones. Saludos