El enlace químico (Fuerza entre átomos y moléculas)
Disculpen mi ausencia ya que hace algunos días no publicaba porque estaba terminando semestre y me encontraba un poco atareada. Pero estoy de vuelta para seguirles impartiendo conocimientos sobre química. En esta oportunidad quise compartir con ustedes las explicaciones más aceptada de cómo se encuentran los átomos unidos entre sí, para componer toda la materia que conocemos.
Toda la materia está constituida por partículas discretas conocidas como átomos y moléculas (2 o más átomos unidos). A su vez cada átomo esta constituidos de núcleos, protones (con carga positiva) y electrones (con carga negativa). En este momento es lógico que nos hagamos una serie de preguntas entre la que destaca, ¿Cómo es posible que diferentes átomos se mantengan unidos para formar las moléculas?
Para responder esta cuestión, debemos pensar en ¿qué tipo de fuerza atractiva existe entre los diferentes átomos? Existen 3 tipos de fuerzas que se nos vienen como respuesta, fuerza gravitacional, fuerza eléctrica y la fuerza magnética. Pero indudablemente con cada respuesta se generan otras preguntas. Como por ejemplo ¿estas 3 fuerzas tienen el mismo efecto en un enlace químico, o es alguna más importante que la otra? Puede ser que la respuesta de esta pregunta, responda algunas otras interrogantes como ¿Es el enlace químico un factor determinante para las propiedades de la materia?
Les mostrare unos ejemplos moleculares con propiedades muy diferentes para darles respuesta de esta interrogante.

Molécula
El flúor y el sodio pueden unirse con una estequiometria de 1:1, NaF produciendo el fluoruro de sodio que es un sólido sin color que funde a 991 °C y ebulle a casi 1705 °. Por otra parte el mismo flúor puede unirse al carbono con una estequiometria de 1:4 para obtener el tetrafluoruro de carbono CF4 que es un gas incoloro que se congela a -184 °C y ebulle a -120 °C. Por otra parte la plata y el cobre son sólidos que conducen la electricidad muy eficientemente mientras que el diamante es un no conductor. De estos ejemplos se puede notar la diferencia tan marcada entre cada uno de estos compuestos, y es común en los muchos compuestos formados por iones (partículas con cargas, tanto positivas como negativas). La fuerza que existe entre iones es atractiva y es conocido como enlace químico. Y su comprensión es muy importante en la transformación de la materia debido a que en cada cambio ocurren modificaciones en los enlaces químicos.
En la naturaleza, casi todos los átomos prefieren estar unidos a otros (enlazados), algunos ejemplos de gases diatómicos son H2, N2, F2, Cl2, Y2. Por otra parte, el fosforo existe como como P4. Y el azufre como S8, S6, S4. Por otro lado si las condiciones se modifican para ciertos compuestos por ejemplo a 1000 °C las moléculas se separaran en átomos. En el sol y las estrellas como las temperaturas son extremas los átomos se encuentran como iones y núcleos individuales.
Muchas moléculas tienden a reordenarse en cortos tiempos de vida, por de formadas inicialmente. Todo debido a la estabilidad o inestabilidad de ellas. Estas cualidades son importantes si se quiere seguir las transiciones de una reacción química.
Tipos de fuerzas entre átomos
Desde los principios de las ciencias los estudiosos de la materia quisieron entender ¿cómo se unían los átomos entre sí? para formar las conocidas moléculas, y estos fueron imaginados de formas muy distintas. Las primeras aproximaciones fueron vistas como se muestra en la figura de abajo. Donde se observa unas especies de ganchos por donde se sujetan o como dientes que se entrelazaban (Debe entenderse que estas primeras propuestas fueron nada realistas). Con el desarrollo de los conceptos de fuerzas estos modelos fueron rechazados rápidamente.

Representación de las primeras suposiciones de los enlaces químicos- Fuente: @VianniS
Cuando existe la unión de átomos generalmente está asociada a pérdida o ganancia de energía en forma de calor, y por ello las fuerzas gravitacionales y magnéticas no son las únicas responsable de la unión de los átomos, es decir, las fuerzas interatómicas. Con esta afirmación se estableció entonces que la mayor fuerza de contribución a los enlaces atómicos son las fuerzas eléctricas. Y desde entonces la atención se fijó en los electrones de los átomos constituyentes de los enlaces.
Símbolos de Lewis
El científico Gilbert Lewis diseño una serie de símbolos conocidos valga la redundancia, símbolos de Lewis para representar la forma como los elementos o átomos se enlazan entre sí, con sus electrones de valencia. Que son los electrones que se encuentran en su última capa electrónica, es decir, los disponibles para formar los mencionados enlaces. (Objeto de estudio en este post). La representación de estos símbolos es sencilla y consta del Símbolo químico de los elementos, rodeados de puntos que representan los electrones de valencia. Observe la figura siguiente donde están los símbolos de Lewis para varios elementos. El número de electrones de valencia (Última capa) está dado por el número de grupo al cual pertenece dicho átomo. Por ejemplo: El Calcio (Ca) se encuentra en el grupo IIA por ende posee 2 electrones en su última capa y por ello en la figura se observan 2 puntos al lado del símbolo.

Símbolos de Lewis ( Algunos elementos) - Fuente: @VianniS
Cuando un elemento posee más de 4 electrones de valencia, estos se colocan por pares alrededor del Símbolo atómico, como en el caso del azufre que posee 6 electrones de valencia. En la figura anterior esquematizo los símbolos para algunos elementos de la tabla periódica con el fin de ejemplificar el método.
Iones enlazados (Enlace iónico)
Cerca de 1900 los científicos William, Ramsey y Morris Travers revelaron el descubrimiento de un nuevo grupo de elementos, que los llamaron gases nobles debido a su alta resistencia a reaccionar químicamente, es decir, son compuestos inertes. Esto llevo a cuestionarse que hacía que estos nuevos elementos fueran tan estables químicamente y así poder entender de mejor manera las reacciones químicas. La estructura química de este nuevo grupo periódico fue estudiada unos 20 años después de su descubrimiento por Walther Kossel, Irving Langmuir y el propio Gilbert Lewis. Con estos estudios se observó que los ganes nobles poseen en su última capa de valencia 8 electrones que le confieren su carácter inerte y que todos los elementos al reaccionar se obligan a quedar con 8 electrones en su última capa para imitar la estabilidad de los gases nobles. Esto es conocido como la regla del octeto
Todos sabemos que los átomos están constituidos por 4 sistemas, el núcleo, los protones, los neutrones y los electrones. Los primeros 3 se mantienen estables y constante durante toda su vida mientras que el número de electrones aumentará o disminuirá con cada reacción química a la cual se someta. Debido a que son los electrones los responsables de formar los enlaces químicos de cada molécula.
En las transferencias electrónicas entre diferentes átomos se forman los iones, estos son elementos que pierden o ganan electrones y estos quedan desapareados de otro electrón. Por ejemplo como se observa en la figura siempre el Cloruro de Sodio es la sal común de mesa, la que utilizamos para cocinar. Esta está compuesta por Sodio y Cloro NaCl. Si se separa el sodio del átomo de cloro el cloro por presentar 7 electrones en su última capa de valencia le sustraerá el electrón del Sodio para quedar la regla del octeto completa y mostrar su mayor estabilidad y se representara como el ion cloruro. Mientras que el sodio al perder un electrón también cumpliría la regla del octeto con 8 electrones en su última capa y estará como el ion sodio positivo. Los dos iones tienen la estructura de su gas noble correspondiente, neón y argón respectivamente.
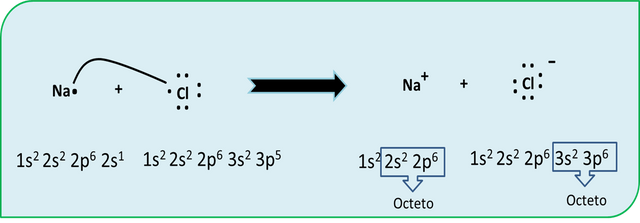
Regla del octeto NaCl- Fuente: @VianniS
Los enlaces iónicos se forman al existir dos iones cargados opuestamente, es decir, un ion positivo atrae un ion negativo y viceversa.
Átomos enlazados (Enlace covalente)
Los enlaces iónicos mencionados en el tratado anterior son la minoría en las reacciones químicas. En cambio son los enlaces covalentes los que dominan estas reacciones. Pero se preguntaran, como es entonces la cuestión de los electrones en un enlace covalente, debido a que en los enlaces iónicos los átomos se ceden o sustraen los electrones para cumplir con la regla del octeto.
Bueno, en los enlaces covalente los átomos se comparten la carga electrónica entre si hasta cumplir los 8 electrones en su última capa. Observen la representación siguiente. En estos nuevos enlaces es común sustituir los puntos de Lewis por un guion que une a los 2 átomos como representación del enlace. ( un par de puntos representa un enlace covalente)
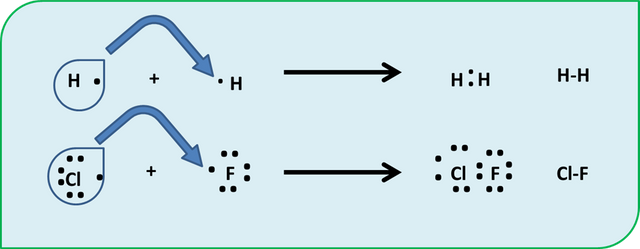
Enlace Covalente- Fuente: @VianniS
Propiedades de los enlaces covalentes
Pero ¿son estos dos tipos de enlaces muy diferentes? Pues la respuesta es no. Imagina que tienes un bote de pintura roja y uno blanco, si agregamos gradualmente la blanca a la roja los tonos se van difundiendo desde el rojo puro al hasta el blanco puro. La situación de los enlaces es igual a los varios tonos de color rosa que se obtendrán dependiendo de la cantidad de uno u otro color. Es decir, imagina dos átomos iguales de hidrogeno unidos por un enlace covalente H-H (o 2 pinturas iguales), ambos átomos atraerán al par de electrón a su núcleo con la misma fuerza, ( en las pinturas siempre tendrás el mismo color si las mezclas), pero si los dos átomos son diferentes H-F uno atraerá con mayor fuerza al par electrónico hasta su núcleo, en este caso el flúor posee mayor fuerza de atracción que el hidrogeno ( o pinturas de diferentes tonalidades, la del tono más oscuro predominará en la mezcla).
Entonces el átomo con mayor fuerza quedara con más carga negativa mientras que el más débil obtendrá una carga parcialmente positiva como los enlaces iónicos. Esto no quiere decir que las moléculas estén cargadas, por el contrario siguen siendo neutras. Pero con un enlace polar (Con polos distintos de cargas)
Momento dipolar
La molécula de ácido clorhídrico podría decirse que es, una molécula polar, H-Cl debido a que el átomo de cloro atrae con mayor fuerza el par de electrones del enlace hacia su núcleo es el átomo parcialmente negativo y el átomo de hidrogeno el parcialmente positivo. Sabemos que en el estado gaseoso la cinética de las moléculas las mantiene en un desorden permanente como se muestra en la figura de abajo (a). Pero este desorden se puede orientar si se agrega al sistema dos placas cargadas eléctricamente, una positiva y otra negativa como en el apartado (b) de la imagen. Donde los polos positivos se dirigirán al lado negativo y los polos negativos al lado positivo lógicamente.
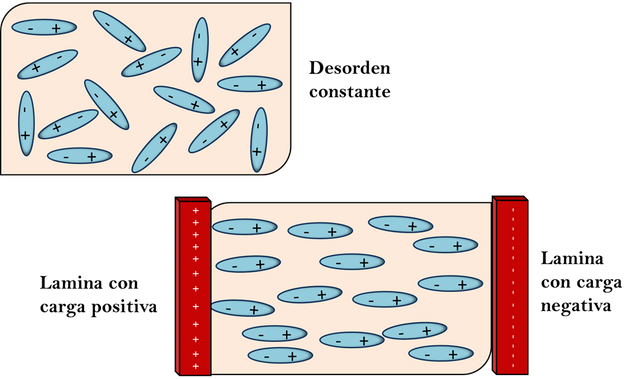
Momento dipolar- Fuente: @VianniS
Estos fenómenos de las moléculas se pueden cuantificar calculando el momento dipolar de la molécula. Esta medida es la cantidad de carga que es atraída por el extremo de la molécula.
Electronegatividad
Es la habilidad de los átomos para atraer hacia su núcleo los electrones de un enlace. Este valor depende de cada átomo, y esta capacidad de atracción va aumentando de izquierda a derecha en la tabla periódica y de abajo hacia arriba. Siendo el Flor y el Oxígeno los más electronegativos de todos. (Vea la tabla siguiente)
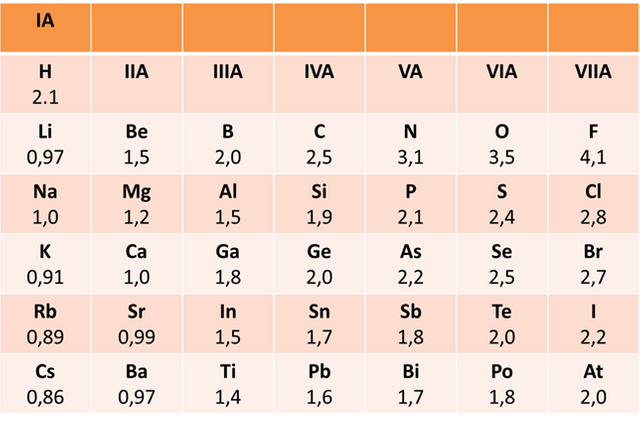
Electronegatividades- Fuente: @VianniS
En una molécula, de acuerdo a la diferencia que exista en las electronegatividades de los diferentes átomos se puede determinar si el tipo de enlace es iónico o covalente. En otras palabras, mientras mayor es la diferencia en la electronegatividad el enlace tenderá a ser iónico. (Por ejemplo el fluoruro de sodio NaF forma un enlace iónico ya que la electronegatividad del sodio es 1 y la del flúor es 4,1). Caso contrario ocurre si la diferencia de esta propiedad es insignificante, es decir, que los átomos atraen con la misma fuerza el par electrónico entonces el enlace que se formará será covalente como en el caso de ácido clorhídrico HCl.
Sustancias Iónicas y Covalentes
La electronegatividad ayuda a establecer hasta cierto punto si una sustancia es iónica o covalente. Pero también se pueden distinguir si observamos sus puntos de fusión y ebullición este último más confiable.
Sustancias covalentes
Las sustancias covalentes tienen un comportamiento como si fueran una sola molécula aun cuando son muchas moléculas unidas entre sí. Como se muestra en la imagen las moléculas iguales están unidas por fuerzas intermoleculares conocidas como las fuerzas de Van der Waals. Que son relativamente débiles. La atracción entre moléculas iguales se debe a la fuerza eléctrica de los polos de la molécula.
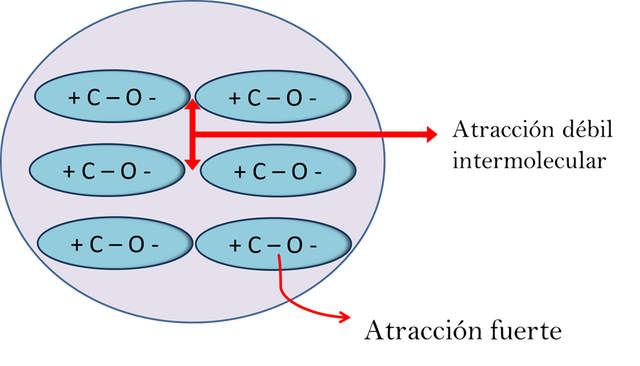
Fuerzas intermoleculares- Fuente: @VianniS
Estas fuerzas son las responsables de mantener unidas las moléculas de líquidos y sólidos. Estas fuerzas atractivas eléctricas son un poco menores que cuando las moléculas son iónicas cargadas. Entonces como las fuerzas intermoleculares son débiles estas pueden ser separadas con mayor facilidad. Por lo que no se necesita de mayor energía para vencer estas fuerzas. En otras palabras, mientras mayor son las fuerzas de atracción mayor energía calórica se necesitara para separar las moléculas. Esto es, cuando se funden los sólidos o ebullen los líquidos, la unión que mantiene las moléculas juntas se rompen y las hace separar. Esto hace que las sustancias covalentes sean estrictamente gases o líquidos volátiles, o solidos con puntos de fusión y ebullición bajos no más de 500 °C.
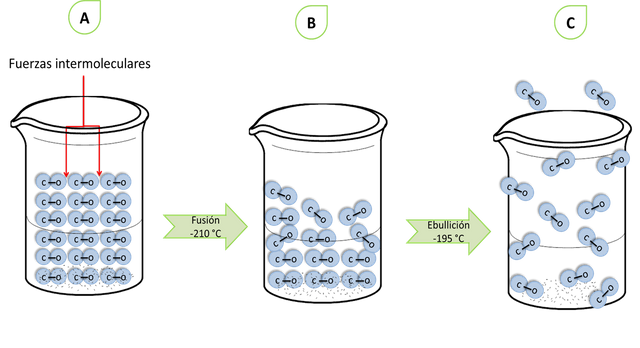
Fusión y ebullición en sustancias covalentes- Fuente: @VianniS
Sustancia Iónicas
Al contrario de las sustancias covalentes, las iónicas se solidifican y no condensan como átomos particulares. Sino como un sólido en una red cristalina donde no se distingue que ion positivo está ligado a un negativo. Por ejemplo la red del cloruro de sodio.
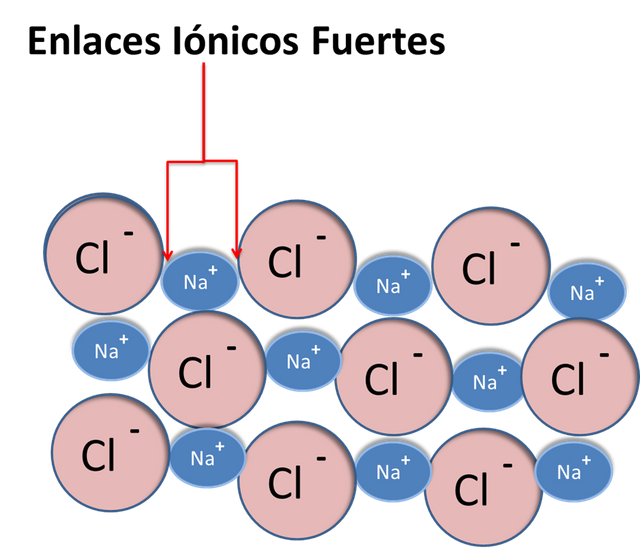
Enlaces en las sustancias Iónicas -Fuente: @VianniS
Para tratar de separar los enlaces iónicos es necesario una energía calórica mucho mayor debido a que los iones son muy difícil de separar. La mayoría de los compuestos iónicos son sólidos con puntos de fusión muy elevados sobre los 800 °C y de ebullición sobre los 1100 °C.
Por otra parte, la característica más importante para identificar a un compuesto iónico es su habilidad de ser conductores en su estado fundido.
Enlaces Dobles y Triples
Existen numerosas moléculas covalentes que para cumplir la regla del octeto deben compartir más de un par de electrones. Un ejemplo muy representativo es el nitrógeno molecular N2 que tiene 5 electrones en su última capa. Si solo se compartiera un par electrónico cada átomo de nitrógeno solo tendría 6 electrones y un octeto incompleto.
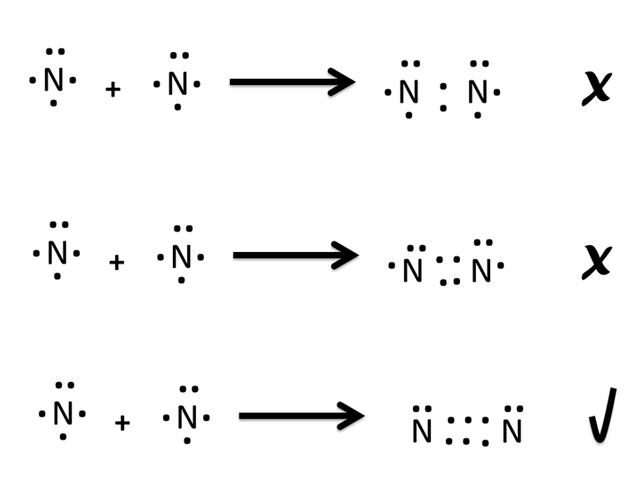
Enlaces múltiples
Por lo que las moléculas deben compartir múltiples enlaces para cumplir con los ocho electrones en su última capa de valencia como se observa arriba.
Este tema es un poco extenso debido a que de el se derivan todas las reacciones químicas y biológicas que ocurren en el universo y para entenderlas se debe entender los comportamientos moleculares tanto inter y intramolecular.
Esperando que este breve repaso e introducción al enlace químico haya hecho entender algunos de los fenómenos asociados. El lenguaje que utilice en algunos casos es necesario para los profesionales de otras áreas distintas a la química.
Nota: Las imágenes y figuras son de mi autoria hechas en powerpoint offices y un emulador de química llamado ChemDraw.
Exceptuando la de la portada.
Referencias complementarias
Frank Brescia, Stanley Mehlman, Frank Pellegrini, Seymour Stambler. Quimica pagina 197
Reymond Chang ** Quimica General** pagina 254.
Siempre nos tienes acostumbrados a buenas y didácticas publicaciones! Felicitaciones
Has recivido un voto por @cultivandojuntos, Un voto hecho por un bot de construccion experimental en la comunidad de la etiqueta español
Congratulations @viannis! You received a personal award!
You can view your badges on your Steem Board and compare to others on the Steem Ranking
Do not miss the last post from @steemitboard:
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Adorando la química cada vez más gracias a tus excelentes aportes @viannis, todo el éxito para ti.
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Las interrogantes planteadas al principio del post me hacen reflexionar de que la química es una ciencia que nos da respuesta a muchas inquietudes sobre la composición de la materia universal, todo lo que vemos y utilizamos esta unidos por atomos y moleculas.
Estudiar la materia desde los elementos más pequeños, pasando por las fuerzas que unen los átomos y las moleculas, nos lleva a estudiar también su descomposición. Tomando en cuenta que la energía nuclear puede ser protagonista en las nuevas fuentes de generación de energía mundial, claro realizando las correcciones de seguridad, para no volver a pasar por los accidentes como los de Chernóbyl.
Debido a esta iniciativa de explicarnos las fuerzas que actúan en los enlaces entre átomos y moléculas es que podemos reflexionar sobre toda la materia existente en el universo y de su composición.
Saludos @viannis y gracias por compartir este excelente contenido.
Hola @viannis, me ha encantado tu publicación aunque confieso que la Química que recuerdo haber estudiado en mi bachillerato fue mayormente teórica, en pocas ocasiones sin práctica de laboratorios. De los enlaces químicos vagamente recuerdo los sencillos, doble y triples, y los estudié en Química Orgánica con la temática de Alcanos, Alquenos y Alquinos, con tu aporte me doy cuenta de que hay mucha más tela que cortar. En ocasión del estudio de la temática que te refiero, recuerdo que el profesor nos aludía un ejemplo en cuanto a las grasas saturadas y e insaturadas para explicarnos que los enlaces sencillos era más difíciles de romper y por eso no era recomendable el consumo de grasas saturadas generalmente de origen animal; en el caso de las insaturadas creo que nos indicaba que estaban relacionadas con enlaces dobles y triples más fáciles de romper y en ese sentido era recomendable el consumo de grasas de origen vegetal, más o menos así. Recuerdo este saber con especial agrado porque era un ejemplo de la Química vinculado a la Biología y la Salud. En cuanto a tu aporte me da una amplia visión de los enlaces químicos que si la estudié sinceramente no la recordaba, en ese sentido pude fortalecer saberes que debería conocer al menos como cultura general. Excelente post, saludos fraternos!!
Congratulations @viannis! You received a personal award!
Click here to view your Board