[Ciencia][Microbiología] OBSERVACIÓN Y TINCIÓN DE MICROORGANISMOS
¡Hola steemians! Después de la revisión de la etiqueta y de las reglas estipuladas por #Stem-espanol realizare mi tercera publicación usando este tag, para compartir con ustedes mi conocimiento en el ámbito biológico e incentivar a esta comunidad al estudio de las ciencias.
Les enseñare a realizar la observación y tinción de microorganismos con tres técnicas:
1. Experiencia del KOH
2. Experiencia de Tinción de Espora.
3. Experiencia de tinción ácido-resistente.
las cuales podrán realizar sin dificultad alguna con un conocimiento básico de microorganismos y técnicas de laboratorio de microbiología, como lo son cultivo por estriado, punción e inoculación.
Objetivo
Observar la morfología bacteriana en suspensión acuosa, la configuración de las colonias crecidas sobre agar y algunas estructuras bacterianas.
Materiales y Métodos
Experiencia del KOH
Materiales:
• Asa de inoculación
• Laminas porta-objetos.
• Tubo de 1ml de E. coli.
• Solución de KOH al 3%.
Procedimiento:
Esta prueba se utiliza cuando se tienen muchas muestras y se quiere tener una rápida caracterización de la población bacteriana. Colocamos una gota de la solución de KOH al 3% sobre el porta objetos, luego abrimos con sumo cuidado el tubo con el cultivo de la bacteria y tomamos una asada con el asa de inoculación, tratando de disgregarla con la gota de KOH, ahora suspendemos el lisado en la lamina porta-objetos y se pudo observar un delgado hilo viscoso, casi incoloro, lo que indica que la bacteria es gran negativa.
Experiencia de Tinción de Esporas:
Materiales:
• Asa de inoculación
• Microscopio
• Laminas porta-objetos y cubre-objetos.
• 1 placa con Sporolactobacillus sp, crecido en agar agua por tres o más días.
• Agua, Verde malaquita y Safranina.
• Trípode con rejilla y un mechero.
Procedimiento:
En esta experiencia se llevó a cabo la tinción de esporas (Método de Schaeffer-Fulton); al igual que en la experiencia anterior se prepara un frotis bacteriano, con tres asadas del cultivo de *Sporolactobacillus sp.*, resuspendiendola en una lamina porta-objetos a la que previamente le habíamos colocado una gota de agua (en lugar de Solución salina NaCl 0,85% p/v, como se suele indicar). Luego de preparar el frotis se montó la torre de calentamiento, que en este caso fue un trípode con rejilla y un mechero. Se cubrió el frotis con un papel de filtro y lo coloreamos con verde malaquita, la lamina se montó en el trípode con rejilla en un vaso precipitado que contenía agua, y se comenzaron a contar 10 minutos desde que esta comenzó a hervir, procurando mantener el papel humedecido durante ese tiempo. Luego de que se cumplió el tiempo establecido se tomó con una pinza la lámina, se apagó el mechero y se procedió a lavar la lamina con agua corriente, el papel de filtro se retira naturalmente y añadimos safranina durante 30 segundos, volvemos a lavar, colocamos un cubre-objetos, dejamos secar naturalmente y procedemos a observarlo en el microscopio. (Ver imágenes 1, 2 y 3)

Imagen 1. Aplicación del verde malaquita en el frotis, luego de colocar el papel de filtro.

Imagen 2.Placa con frotis y verde malaquita, durante 10 minutos en el tripoide con rejilla y el mechero.
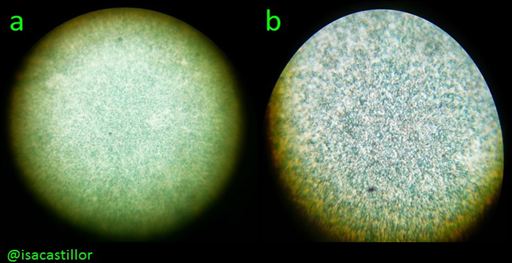
Imagen 3. Tinción de esporas a. visto a microscopio sin aceite de inmersión, b. visto a microscopio con aceite de inmersión
Experiencia de tinción ácido-resistente:
Materiales:
• Asa de inoculación
• Microscopio
• Laminas porta-objetos y cubre-objetos.
• Tubos de cultivo con 1ml de Mycobacterium smegmatis y S. aureus.
• Agua, Carbol-fucsina, alcohol-acido y azul de metileno.
Procedimiento:
En esta experiencia se llevó a cabo la tinción ácido-resistente (Método de Ziehl-Neelsen); al igual que en la experiencia anterior se prepara un frotis bacteriano, pero en este caso con tres asadas del cultivo de *Mycobacterium smegmatis* y *S. aureus*, luego de preparar el frotis se le coloco el papel de filtro y se coloreo con carbol-fucsina, la lámina se montó en el trípode con rejilla en un vaso precipitado de contenía agua, y se comenzaron a contar 10 minutos desde que esta comenzó a hervir, procurando mantener el papel humedecido durante ese tiempo. Luego de que se cumplió el tiempo establecido tomamos con una pinza la lámina, apagamos el mechero y lavamos con agua corriente, el papel de filtro se retira naturalmente y decoloramos con alcohol-acido, lavamos y añadimos azul de metileno por un minuto, lavamos con agua corriente nuevamente y colocamos el cubre-objeto, dejando secar de forma natural para finalmente observarla en el microscopio (Ver imágenes 4, 5 y 6)

Imagen 4. Frotis con papel de filtro, aplicando el carbol-fucsina.

Imagen 5. Se mantuvo el frotis, durante 10 minutos de carbol-fucsina en el tripoide con rejilla y el mechero.

Imagen 6. Frotis a simple vista con papel de filtro, y el carbol-fucsina fijado después de aplicar calor durante 10 min.
Resultados
Se realizó la experiencia conocida como “prueba de KOH”, se utilizó E. coli para esta prueba, efectivamente una sustancia viscosa fue lo que se evidenció en el porta objetos y un hilo de ese material viscoso es lo que se observaba al levantar el asa.
En la experiencia siguiente se tiñeron esporas, la batería trabajada fue Sporolactobacillus sp., se logró divisar con mucha dificultad las esporas, sin embargo se hizo imposible distinguir la posición de la misma.
La experiencia de la tinción ácido-resistente, se realizó dos veces, en el primer montaje la cantidad de bacterias en la muestra no era suficiente entonces no se observó ningún organismo al microscopio. En el segundo montaje se varió en el método, para extender la gota, es decir, en lugar de utilizar una lámina porta objetos como se hizo en el primer montaje se extendió la gota con el asa de inoculación de manera que quedara más cantidad de bacterias en el frotis. Se observaron bacilos color rosado.
Discusión General
Para la diferenciación de bacterias Gram+ de las Gram- se hizo uso de un método muy sencillo y eficaz que consiste en el uso de KOH, esta técnica se basa también en la pared externa de las células, las bacterias Gram+ con sus duras y gruesas paredes de peptidoglicano no hacen lisis al añadirles el KOH, mientras que las bacterias Gram- al poseer un pared más delgada y porosa, se lisan y permiten la salida de ADN de la célula, lo que provoca que el frotis se convierta en un líquido viscoso (Zinsser, 1994). En el laboratorio se hizo un frotis bacteriano con E. coli donde se agregó KOH, por la aparición del hilo viscoso se llegó a la conclusión de que es Gram- .
La edad del cultivo es sumamente importante al hacer la tinción, ya que cultivos más viejo de 24 horas pueden perder su habilidad de retener el complejo cristal violeta.
Como método específico se utilizó la tinción de esporas por el método de Schaeffer-Fulton, permitiendo su observación de un color verdoso. Se puede decir que la producción de esporas confiere una gran ventaja a estas bacterias sobre las que no las producen ya que estas estructuras, gracias a sus membranas, permiten la sobrevivencia del organismo a condiciones ambientales extremas y su diseminación cuando estas condiciones vuelvan a ser aptas (Prescot y col, 2002).
Otro método diferencial utilizado fue el ácido-resistente o método de Ziehl-Neelsen, esta técnica se basa en la concentración del ácido mycólico en el interior de la célula, este ácido está presente en Mycobacterium smegmatis, estas células absorben el color del carbol fucsina y cuando se agrega el alcohol-ácido estas no lo absorben ya que su concentración de ácido interna es casi idéntica a la exterior; S. aureus también absorbe el carbol fucsina pero al agregarle el alcohol-ácido este puede penetrar en sus células lo que provoca que pierda el color (Zinsser, 1994)
Conclusiones
1. El test de solubilidad en KOH es sumamente fácil de preparar y con tan solo la presencia de un hilo sabremos que se trata de una bacteria gram negativa, es decir al levantar el asa de inoculación y observar presencia/ausencia de filancia identificaremos a que genero (positiva o negativa) pertenece la bacteria, en este caso E. coli es gram negativa.
2. La tinción de Shaeffer-Fulton, permite visualizar esta estructura bacteriana, difícil de teñir, siendo muy útil para detectar una contaminación por endosporas, es necesario de un buen microscopio para la visualización de la posición de las mismas.
3. La técnica de Z-N fuerza la penetración de la fucsina básica en la pared celular mediante la acción combinada del fenol y el calor. El calentamiento aumenta la energía cinética de las moléculas del colorante lo cual también facilita su entrada a las bacterias y el fenol actúa a modo de disolvente, permitiendo el paso del colorante básico que se une a los ácidos micólicos con carga negativa. Por lo tanto es sumamente útil ya que las bacterias que resisten la decoloración son de color rojo, sobre un color azul (que lo provee el colorante de contraste Azul de metileno).
Por lo tanto se logró clasificar bacterias en gram positivas o negativas con las experiencias antes mencionadas, además gracias a la tinción fue posible observar la forma de cada bacteria con la que se trabajó. Aunque la información obtenida no es suficiente para caracterizar a las bacterias, igual es un buen comienzo para iniciarnos en el estudio de las mismas.
Referencias
• Prescot, L; Harley, J; Klein, D. 2002. Microbiología. Editorial Mc Graw Hill. 5º edición. España.
• Joklink, W; Willett, H; Amos, B; Wilfert, C. 1994. Zinsser, Microbiología. Editorial médica panamericana. 20º edición. Buenos Aires.
• Guía de prácticas de Laboratorio de Microbiología General BC-3361; de la división de ciencias biológicas y el departamento de biología celular de la USB.
OBSERVACIÓN: Los procedimientos que se llevaron a cabo fueron basados en la “Guía de prácticas de Laboratorio de Microbiología General BC-3361; de la división de ciencias biológicas y el departamento de biología celular” de la USB.
Fuente de fotografías: son de mi autoría @isacastillor, usando mi cámara celular durante la aplicación de las técnicas.
Espero les haya gustado este post y haber contribuido al conocimiento científico dentro de la comunidad #stem-espanol. Seguiré compartiendo contenido de biología pura en los ámbitos de: microbiología, genética, química y bioquímica, tanto básica como avanzada.

Siendo un SteemStem Estados
La explicación de la técnica está espectacular. El manejo cuidadoso de los portamuestras y la colocación en el mechero son primordiales para un buen test y clasificación de las bacterias. Buen artículo presentado en la comunidad #stem-espanol
Gracias por leerlo, efectivamente la técnica es fundamental, lamento no disponer de mejores microscopios para que la técnica de tincion de esporas hubiese tenido un mejor resultado y visualizacion. Espero seguir colaborando con esta excelente comunidad!!
Excelente explicación de las coloraciones, yo he trabajado con ellas muchas veces en el área de bacteriología, sobre todo con la tinción de Ziehl-Neelsen para la identificación de bacterias ácido-alcohol resistentes. saludos
Muchisimas gracias, vi que estudias bioquímica clínica, espero mas adelante también publicar post de bioquímica y que sean de tu agrado, el mundo de las ciencias es fascinante y todas tienen una relación increíble.
publicación increíble
Muchas gracias!!
Que maravillosa publicación, el mundo de la microbiología es asombroso, y genial aplicación de las técnicas, ayudas a que otros aprendan a llevarlas a cabo, gracias.
La microbiologia y genetica son dos de las ramas que mas me apasionan y de lo que mas publicare. Gracias por leer, justamente el objetivo es motivar a mas personas al estudio de las ciencias.
Te felicito @isacastillor muy didáctica tu presentación de la tinción
Excelente post, muy buena la explicación. Gracias por compartir.
@isacastillor Excelente post por su contenido y referencia.
Un consejo para que los géneros y especies te queden en cursivas es utilizar los " _ " antes y después de cada palabra (Ej: Escherichia )
Sigue así, exitos!