Reacciones con sulfato cúprico. Los colores de los compuestos con cobre.
La forma metálica del cobre no es la única en encontrar especiales aplicaciones, el sulfato cúprico, o sulfato de cobre (II), es un compuesto de gran relevancia industrial; tiene aplicaciones en la agricultura como pesticida y abono, como alguicida en el tratamiento de agua, como pigmento en cueros y cerámica, y para producir recubrimientos de cobre sobre otros metales.
El sulfato de cúprico es una sal cristalina que tiene una estructura compleja, en la sal hidratada (CuSO4.5H2O) cada ion de cobre se coordina con cuatro moléculas de agua mientras que una quinta molécula se une al grupo sulfato mediante puentes de hidrogeno, pasa muy desapercibido, pero esta estructura es la responsable de una serie de espectaculares colores.

Imagen de cobre metálico (izquierda) y sulfato cúprico (derecha). Fuente: propia.
Quédense a leer para mostrarles algunas interesantes reacciones con sulfato cúprico pentahidratado.
 Fuente: propia.
Fuente: propia.¿Qué utilizaremos?
Sulfato cúprico pentahidratado
Amoniaco en solución (0,1 M)
Ácido ascórbico en solución (vitamina C)
Hidróxido de sodio (6 M)
Cloruro de sodio (sal de mesa)
Tubo de ensayo y vasos precipitado
Plancha de calentamiento
Deshidratación del sulfato cúprico
Por lo general, cuando se hace referencia al sulfato cúprico en su forma de sal cristalizada de color azul estamos hablando del sulfato cúprico pentahidratado, de formula CuSO4.5H2O, realmente la sal anhidra de este compuesto tiene un color blanco pálido. Si deseamos obtener la sal anhidra a partir del sulfato cúprico pentahidratado, basta con calentar la sal directamente sobre una plancha de calentamiento, poco a poco el agua de hidratación se irá perdiendo en forma de vapor, y paulatinamente observaremos como ese tono azul va cambiando a un tono blanquecino.

Imagen de sulfato cúprico pentahidratado (izquierda) y sulfato cúprico anhidro (derecha). Fuente: propia.
Entonces, si la sal anhidra es de color blanco, el tono azul lo confieren las moléculas de agua atrapadas en la estructura de la sal.
La explicación
El sulfato cúprico pentahidratado posee una estructura algo compleja, como se menciono antes, el ion cobre se coordina con cuatro moléculas de agua, y a la quinta se une mediante puentes de hidrogeno, esto hace que se forme una estructura tetraédrica distorsionada en torno al ión metálico.
En la sal anhidra el catión Cu2+ tiene la configuración electrónica [Ar]3d9, por lo que tendría nueve electrones dispuestos en los cinco orbitales d, disponiéndolos en dos niveles diferentes (t2g y eg) que, a groso modo, debido a las distorsiones se desdoblan, el cambio de color dependerá de la distorsión. Así, en la sal anhidra se forma una estructura tetrahédrica en la que el átomo de cobre ocupa los vértices y centros de las caras alternos mientras que el azufre ocupa los huecos; pero en la sal pentahidratada, el cobre interactúa con seis ligandos (cuatro H2O y dos sulfatos), lo que distorsiona el plano axial, como se observa en las siguientes estructuras.
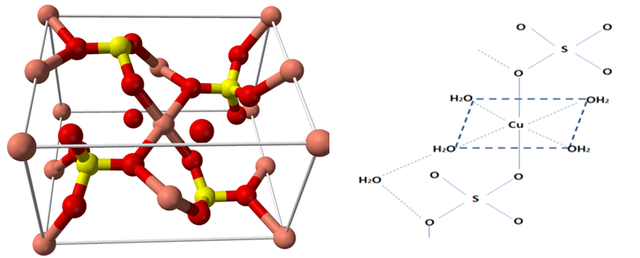
Imagen de la celda unitaria del sulfato cúprico (izquierda), fuente: Mills, B.
y de la estructura del sulfato cúprico pentahidratado (derecha), fuente: propia
En el caso del sulfato cúprico pentahidratado, los ligandos con el agua son de campo débil, lo que quiere decir que causan una pequeña variación de energía entre estos niveles pero que son suficientes para producir transiciones electrónicas entre ellos, las cuales absorben radiación en la longitud de onda en torno a los 600 nm, con lo cual se absorbe el color naranja y se emite el color azul.
Obtención de cloruro de cobre
Comencemos esta experiencia disolviendo suficiente sulfato cúprico en agua para obtener una solución aproximadamente 1 M de concentración. Si colocamos 2 mL de esta solución (de color azul) y le agregamos cloruro de sodio (NaCl), obtendremos una solución de color verde.

Imagen de la solución de sulfato cúprico (A) y del cloruro de cobre (B). Fuente: propia.
Observemos el siguiente video
La explicación
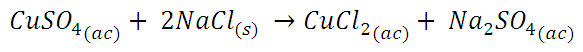
La solución se torna verde debido a que la sustitución de los ligandos H2O por ligandos Cl-, de campo menos intenso, provoca que la energía absorbida sea menor, en el rango de los 400 nm, con lo cual el complejo toma colores amarillentos, sin embargo, en soluciones concentradas también se forman complejos Cu[(H2O)6]2+ de color azul, la solución se torna verde por combinación de los tonos azul y amarillo.
Obtención de cobre metálico
El cobre metálico no solo puede obtenerse de su estado nativo en la naturaleza, sino que también puede obtenerse a partir de sus compuestos. A partir del sulfato cúprico podemos obtenerlo por la formación de precipitados de diversos complejos. Si disponemos de 2 mL de la solución de sulfato cúprico en el tubo de ensayo y le añadimos paulatinamente solución de amoniaco, notaremos dos cosas, 1) la formación de un precipitado turquesa (se nota más bien como si la solución se tornara turbia) y 2) que luego la solución adquiere un color azul. Si luego agregamos el ácido ascórbico (vitamina C) observaremos que la solución se torna naranja, si dejamos reposar notaremos que se debe a la formación de un precipitado rojizo, el cual corresponde a cobre metálico.
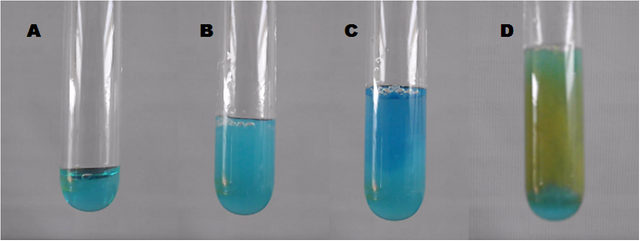
Imagenes de: sulfato cúprico (A), precipitado turquesa (B), complejo amoniacal color azul (C) y precipitado de cobre metálico (D). Fuente: propia.
Observemos el siguiente video
La explicación
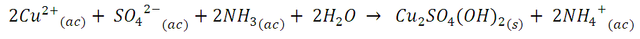
Sin embargo, al continuar añadiendo la solución de amoniaco, este precipitado se disuelve formando el complejo tetraamincúprico, Cu(NH3)42+, de acuerdo a la siguiente reacción,
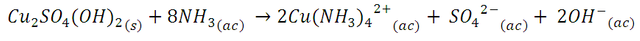
Esta serie de reacciones introduce en la solución la formación de ligandos amoniaco (NH3) de campo más fuerte, cuya distorsión absorbe el espectro amarillo, dando lugar a una solución de color azul más intenso.
Al agregar el ácido ascórbico a la solución, este actúa como un agente reductor, cediendo los electrones necesarios para dar lugar a la reducción de los iones cobre a cobre metálico, el cual aparece como un fino polvo naranja en el medio, que al dejar reposar podemos notar mejor su color rojizo característico.
Obtención de hidróxido de cobre y óxido de cobre.
El sulfato cúprico también puede generar precipitados de color aun más intensos. Si por ejemplo disponemos de 2 mL de la solución de sulfato cúprico en el tubo de ensayo y agregamos progresivamente hidróxido de sodio notaremos la formación de un precipitado azul de aspecto gelatinoso, y al continuar añadiendo hidróxido de sodio se torna de un azul aun más intenso. Si luego pasamos a calentar esta mezcla, notaremos que el precipitado se va disolviendo y va adquiriendo un tono más oscuro hasta dar lugar a la formación de un precipitado negro.

Imagen de los precipitados de: hidróxido de cobre (A) y óxido de cobre (B). Fuente: propia.
Observemos lo que ocurre con este video
La explicación
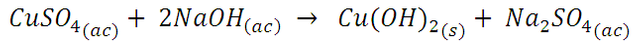
Al continuar agregando el hidróxido de sodio el precipitado adquiere un tono más intenso, esto se debe a que en soluciones fuertemente básicas se propicia la formación del ion cuprato (CuO22-), de un tono de azul más oscuro y con el calentamiento, se disuelve el precipitado de hidróxido de cobre y se obtiene un precipitado de óxido de cobre (CuO) el cual es de color negro. Estos compuestos tienen una estructura tetraédrica y cuadrada plana que implican una menos absorción de energía, dando complejos de colores oscuros (índigo y negro).
Referencias
Sulfato de cobre (II)
Cobre
Heredia, S. (2006). Experimentos con sulfato de cobre. Revista Eureka, pp. 467-484.
Complejos del cobre
¡Felicitaciones!
Estas participando para optar a la mención especial, que se efectuará el 05 de Agosto del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Muchas gracias por el apoyo amigos de @entropia.
Saludos @emiliomoron. Impresionante trabajo el que compartes con nosotros. Tu dominio en la explicación y tu didáctica es de primera. Interesante trabajo. Mis felicitaciones. Gracias por traerlo con nosotros.
Saludos amigo @lorenzor. Muchas gracias por tu apreciación y comentario mi estimado, fue un placer para mi compartirlo, me alegra que le haya gustado.
Amigo @emiliomoron, me gustó mucho su artículo. Muestra muy bien, con su contenido teórico y con los vídeos, algunas de las reacciones químicas donde está involucrado el cobre. Ciertamente, es un material que se usa extensamente en la fabricación de alambres para embobinados y cableados, y en la fabricación de conductos para fluidos (incluyendo conexiones y grifos). Disfruté leerlo. Gracias por compartirlo.
¡Saludos!
Gracias por el comentario amigo @tsoldovieri, me alegra que lo haya disfrutado, ese es el principal proposito, fue un gusto para mi compartirlo. Mis saludos!
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Hi @emiliomoron!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
La ciencia es muy divertida tus experimentos son prueba de ello.
Gracias Breili. Me alegra que lo disfruten!