Obtención de recubrimientos metálicos por vía electrolítica. Electrodeposición.
Saludos estimados amigos.
En un anterior post les comenté sobre la utilidad de diversos elementos con recubrimientos metálicos, mostrándoles un ejemplo de la deposición de zinc sobre cobre mediante una reducción química; pues bien, la reducción electrolítica es otro medio de obtener metales activos, así como también suele emplearse para purificar o refinar metales que se encuentran en su estado libre (no combinado), a este procedimiento de depositar un metal sobre una superficie por acción de la corriente eléctrica también se le conoce como electrodeposición. Y con esta publicación quiero mostrarles el fundamento del proceso y un ejemplo de aplicación al depositar estaño sobre una moneda de cobre.

Sistema para la electrodeposición de estaño. Fuente: propia
Como bien sabemos, en nuestra sociedad se consume grandes cantidades de artículos metálicos, las joyas se recubren con oro y plata, contactos eléctricos se recubren de cobre, piezas de vehículos se recubren con cromo, así como artículos deportivos, solo por nombrar algunas de las aplicaciones que hacen de la electrodeposición uno de los procesos electroquímicos de mayor uso a nivel industrial, no solo por el volumen de producción sino también por el impacto asociado, ya que piezas que generalmente están constituidas de metales económicos adquieren mejores características, como resistencia a la corrosión o mayor belleza.
Entonces, quédense a leer para conocer más sobre este procedimiento químico tan útil para la industria.
Fundamentos
Electrolisis
Es el proceso mediante el cual se utiliza la corriente eléctrica para forzar que se produzcan reacciones químicas de oxido-reducción (redox) no espontaneas. El sistema reaccionante está constituido por una celda y la corriente entra y sale desde los electrodos, a este tipo de celda se le conoce como celda electrolítica, otro tipo de celda son las denominadas celdas voltaicas o galvánicas, en las cales una reacción espontanea produce energía eléctrica capaz de suministrarse a un circuito eléctrico.
Electrodos
Los electrodos son superficies metálicas en las que se producen reacciones de oxidación y reducción, pudiendo o no intervenir en dichas reacciones. Cuando no intervienen se conocen electrodos inertes, a su vez, el electrodo en el cual las especies químicas ganan electrones sufriendo así la reducción se denomina cátodo, mientras que el electrodo en el cual se producen oxidaciones, es decir, donde las especies químicas pierden electrones, se denomina ánodo.
Celdas electrolíticas
Estas celdas constan de un recipiente y dos electrodos que se encuentran sumergidos en un medio reaccionante, estos electrodos se encuentran conectados a una fuente de corriente continua. Su funcionamiento es contrario al de la celda galvánica, en la cual, mediante una reacción redox se obtiene corriente eléctrica.
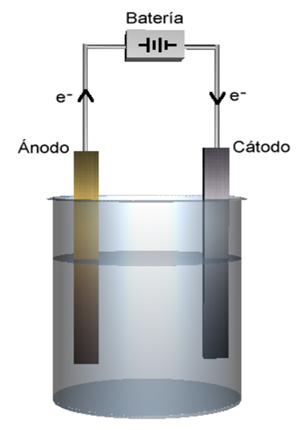
Esquema general de una celda electrolítica. Fuente: Mbarousse, imagen de dominio público.
Electrodeposición de estaño sobre cobre
Para demostrar el proceso de electrodeposición utilizaremos como ejemplo el proceso de deposición de estaño sobre cobre. Para realizarlo utilizaremos un alambre de estaño y una moneda de cobre, colocaremos los metales en un envase con solución electrolítica, la moneda de cobre será la pieza que vamos a recubrir con una capa de estaño, por lo tanto, esta pieza deberá adoptar la función del cátodo en la celda, para ello se conectará al terminal negativo de un generador de corriente continua. El alambre de estaño se conectará al terminal positivo y cumplirá la función del ánodo. Al cerrarse el circuito, el flujo de corriente eléctrica fuerza al estaño a oxidarse y pasa a la solución en forma de iones Sn+2; estos iones en solución luego son reducidos a estaño metálico en el cátodo, quedando depositados sobre el cobre en el proceso. Como resultado neto no hay una reacción, es decir, una conversión de una especie química en otra, sino una transferencia de iones estaño desde el ánodo a la disolución, y desde esta al cátodo, logrando así el recubrimiento metálico de la pieza. Las semireacciones del proceso se escribirían de la forma:
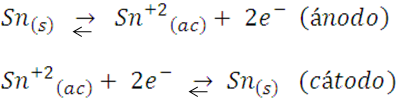
Aunque de forma global no se observe una reacción, durante el proceso el cátodo (la moneda de cobre) gana masa al cubrirse con una fina capa de estaño (imagen A), mientras que en el estaño se observa la pérdida de masa (imagen B). Estos son los resultados:

Resultado de la electrodeposición: A) moneda recubierta, B) estaño gastado. Fuente: propia.
Los iones estaño no pasan a la solución de forma espontanea (es decir, este metal no se disuelve al colocarse en la solución), pero al suministrarse energía eléctrica al sistema la reacción se produce. Los electrones son formados en el ánodo (donde se produce la oxidación) y se consumen en el cátodo; y así, la fuente de corriente continua obliga a los electrones a moverse del electrodo positivo al negativo, por lo tanto, en todas las celdas electrolíticas el ánodo es el electrodo positivo y el cátodo el negativo.
Bien, pongamos en práctica este fenómeno.
Necesitaremos:
• Un erlenmeyer o recipiente de vidrio
• Solución de HCl al 15% como medio electrolítico (yo utilice una solución comercial limpiadora, por eso el color rojo del líquido)
• Una moneda de cobre
• Un trozo de alambre de estaño
• Una batería de 9V
• Cable conductor

Materiales empleados en la experiencia. Fuente: propia
Procedimiento:
• La celda estará constituida por el erlenmeyer con la solución de HCl, deberemos agregar tanta solución como para cubrir por completo los metales.
• Tomaremos los cables y los conectaremos a los terminales de la batería, y luego uniremos el estaño al cable conectado al terminal positivo, y la moneda de cobre la uniremos al cable conectado al terminal negativo.
• Luego sumergiremos los metales en la solución cerrando el circuito.
• Al cabo de un minuto ya observaremos el color plateado que ha adquirido la moneda, pudiendo retirarla de la solución y enjugarla con agua.
• Y listo, sorpréndete con el resultado.
Precaución: recuerden que la solución de HCl, aun la vendida como limpiador de pocetas, es un compuesto ácido corrosivo, por lo que deben manejarla tomando en cuenta las consideraciones de seguridad que amerita.

Referencias
- K. W. Whitten (1985). Química general. Interamericana.
- Wikipedia. Electrodeposición
- Wikipedia. Celda electroquímica
¡Felicitaciones!
Estas participando para optar a la mención especial, que se efectuará el 02 de Septiembre del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias equipo de entropía
Muy buena demostración de las aplicaciones de la electroquímica mi estimado @emiliomoron
Muchas gracias @yusvelasquez!
Excelente Post, veo que pones en practica las reacciones de oxido reducción. Muy ingeniosa la idea de utilizar limpiador como medio ácido. Saludos.
Muchas gracias @aleestra. Si, como te comenté son de las reacciones que me resultan más interesantes, y bueno aprovechando los materiales que tenemos a la mano jeje. Saludos!
Una explicación súper clara @emiliomoron y con el vídeo buenisimo. Felicidades.
Saludos @fran.rey, me alegra que llegará la información de forma clara, gracias a ti por pasar a leer!
Extraordinaria publicación @emiliomoron ...donde nos muestras un claro ejemplo de la #educación-STEM al ofrecer a los docentes y jóvenes estudiantes, así como a la comunidad en general, una de las fases diacrónicas de la investigación más llamativas (la fase aplicativa o tecnológica). Sin duda es una experiencia que despierta el interés de los discípulos por la ciencia -particularmente por la química-. Felicitaciones !
Gracias por tus palabras estimado @tomastonyperez, ciertamente lo más llamativo de la investigación es la aplicación, y eso espero lograr, poder despertar interés por la química que tanto me gusta. Gracias por pasar a leer!
Querido @emiliomoron siempre me emociona ver contenido de química en nuestra comunidad. sinceramente impecable tu demostración. Saludos
Hola amiga @viannis, me pasa lo mismo jeje, ojala pudiera contribuir tanto como quisiera. Gracias por tu apreciación y comentario positivo, saludos!
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
thank you very much!
Que emocionante este experimento.
Gracias Breili. Si es muy emocionante ponerlo a prueba!