Introducción a la química de las sales
Saludos amigos de steemit y apreciados lectores, ¡especialmente a los amantes de la ciencia que forman parte de esta plataforma!

Ejemplo de sales: cloruro de sodio (blanco), cloruro férrico (amarillo), dicromato de potasio (naranja). Fuente: @emiliomoron.
Cuando en química hablamos de sal, hacemos referencia a un grupo grande e importante de compuestos, que van desde el cloruro de sodio (la sal de mesa), el yeso, pasando por sales de metales pesados, como el Yoduro de plomo, hasta sales de metales nobles, como el vanadato de amonio. Y comprender el comportamiento de este tipo de compuestos es muy importante, ya que, tanto en la industria, el ambiente y la salud, muchos procesos y problemas están relacionados con la solubilidad de las sales. Por definición, se entiende que una sal es:
un compuesto químico formado por la unión de átomos de elementos metálicos y no metálicos unidos mediantes enlaces iónicos, que forman cristales generalmente solubles en agua, producto típicamente de una reacción entre un ácido y una base[1].
La presencia de las sales en la naturaleza, y los procesos para su extracción, recuperación y purificación, y uso dependen en gran medida del fenómeno de solubilidad y de su química cuando se encuentran en solución, siendo estos la disolución, cristalización, hidrólisis y formación de complejos. En el presente post describiremos algunos aspectos generales de estos compuestos.
Formación de las sales
En cuanto a lo que química se refiere, podemos encontrar diferentes tipos de reacciones que conducen a la formación de sales. Siendo estas:
• Neutralización: es la forma más común de obtener sales, se obtienen mediante la reacción entre un ácido y una base, el ejemplo más común de todos es la neutralización del ácido clorhídrico con hidróxido de sodio para formar sal común (NaCl) y agua.
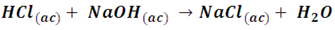
Cuando reacciona un ácido monoprótico (es decir, que contiene un solo átomo de hidrógeno) se produce una sal binaria, también llamada haloidea, constituida por la unión un metal más un no metal, como en el ejemplo anterior. En la sal de mesa el 40% de su masa corresponde al sodio y 60% al cloruro.
Mientras que, si en la reacción participa un ácido poliprótico (más de un hidrogeno) y este se neutraliza completamente, se obtiene una sal ternaria, como cuando reacciona el ácido sulfúrico con hidróxido de sodio.
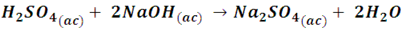
Aunque la sal, sulfato de sodio, Na2SO4, contiene más de tres átomos, se dice que es ternaria ya que está constituida de tres elementos (sodio, azufre y oxígeno).
Notaremos que en las reacciones de neutralización en los productos, además de la sal, se forma agua.
• Reacción de desplazamiento entre un metal y un ácido: en esta reacción el átomo de un metal desplaza al átomo de hidrogeno del ácido. Por ejemplo, en la siguiente reacción:
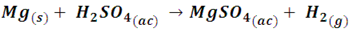
En el siguiente video podremos observar como al sumergir una cinta de magnesio en ácido sulfúrico, comienza a burbujear debido al desprendimiento de hidrógeno.
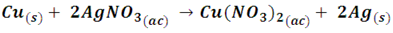
En este caso, se observa que el Cu metálico en estado libre desplaza a la plata que forma parte de una sal, formando otra sal, el nitrato de cobre y dejando los iones plata en la solución, efecto que podemos observar en la siguiente imagen.

Reacción de desplazamiento del cobre en nitrato de plata. Se observa la deposición de la plata metálica sobre el alambre. Fuente: @emiliomoron.
• Reacción de combinación entre un metal y un no metal: las sales también se pueden formar por reacción directa entre un elemento metálico y uno no metálico, por ejemplo, el calcio y el cloro se combinan para producir el cloruro de calcio, una sal utilizada como medicamento para tratar enfermedades ligadas a la deficiencia de calcio o con propósitos alimenticios, como darle mayor firmeza a la cuajada durante la elaboración de quesos[2].
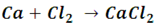
• Reacción entre dos sales: mediante una reacción de doble sustitución dos sales reaccionan intercambiando sus cationes, produciéndose así dos sales diferentes a las iníciales.
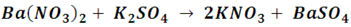
• Reacción entre un óxido con una base o un ácido: si un óxido reacciona con una base o con un ácido tendrá lugar la formación de una sal, por ejemplo cuando se hace reaccionar el óxido hipocloroso con hidróxido de sodio se puede obtener el hipoclorito de sodio (NaOCl); si, esta sustancia conocida en el hogar más como un blanqueador o como agente oxidante para potabilizar el agua es una sal.
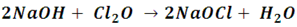
¿Las sales pueden ser ácidas y básicas?
Si, las sales cuando se disuelven en agua, pueden reaccionar para producir iones H3O+ u OH-. Y en función de que tan fuerte actúe cada ion se producirán valores de pH variables, que les pudieran conferir un carácter ácido, básico o neutro.
Hay varios principios que nos dan referencia del tipo de sal que se obtendrá en una reacción.
Por ejemplo, la sal de mesa (NaCl) la podemos consumir sin ningún riesgo ya que es una sal neutra, esta sal que se deriva de la reacción de un ácido fuerte y una base fuerte no se hidroliza y el pH permanece neutro, es decir en 7. Esto se debe a que los haluros y los metales alcalinos al disociarse en la solución no afectan el potencial de hidrógeno, ya que el catión metálico no altera los iones H+ y tampoco el anión del no metal no arranca iones H+ del agua.
En general se puede decir que las sales que contienen un halógeno (excepto el F-) y un metal alcalino (excepto Be) forman sales neutras. Además del NaCl, podemos ingerir de forma segura otros cloruros, por ejemplo, la sal de sodio es necesaria para el organismo pero su uso en exceso puede derivar en problemas como la hipertensión, por ello existen opciones para salar las comidas con condimentos bajos en sal, que no son otra cosa que condimentos que equilibran el contenido de sal con cloruro de potasio, KCl. En varios estudios se ha propuesto la sustitución parcial del NaCl por otras sales como KCl, MgCl2 o CaCl2 para el curado de alimentos como jamones y quesos[3]. Otra sal binaria tolerada por el organismo es el Yoduro de sodio (NaI), la cual es muy utilizada en medicina para tratar patologías de tipo tiroideas[4].

Ingredientes de un producto comercializado como bajo en sal. Fuente: @emiliomoron.
Ahora bien, cuando reacciona una base fuerte con un ácido débil, se produce una sal que se hidroliza, lo que le da a la solución un pH mayor a 7, es decir de carácter básico. Lo que ocurre en este caso es que el anión de la sal, derivado del ácido débil es capaz de aceptar un protón del agua, haciendo que el agua actúe como un ácido en la reacción liberando el ion hidroxilo, OH-. El catión, que proviene de una base fuerte, un metal alcalino o alcalino terreo no se hidroliza, por lo que actuará como un ion espectador y no alterará el pH de la solución.
Por ejemplo, cuando reacciona el ácido acético (un ácido débil) con el hidróxido de sodio forma la sal acetato de sodio. Esta sal se disocia produciendo el ion acetato (CH3COO-) y el ion sodio (Na+) según la siguiente reacción:
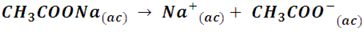
El ion sodio al ser el ácido conjugado de una base fuerte actuará como un ácido débil, por lo que no tiene tendencia a aceptar iones OH- y regenerar la base NaOH. En cambio, el ion acetato al ser la base conjugada de un ácido débil actuará como una base fuerte y tenderá a aceptar protones y regenerar el ácido.
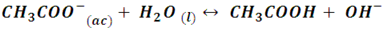
En el proceso se liberan iones OH- que modifican el pH de la solución, dándole el carácter básico.
Por otro, cuando reacciona una base débil con un ácido fuerte, las sales producto de la reacción se hidrolizan conduciendo a que la solución presente un pH inferior a 7, dándole un carácter ácido. Esto se debe a que el catión de la base débil es capaz de donar un protón al agua, formando iones hidronio. Por ejemplo, cuando se disocia el cloruro de amonio, produce aniones cloro y cationes amonio, estos últimos sufren hidrólisis al derivarse de una base débil:
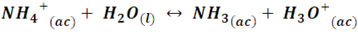
Por lo que se puede decir que el cloruro de amonio es una sal ácida.
También son sales ácidas aquellas que se derivan de la sustitución parcial de los hidrógenos en un ácido poliprótrico . Digamos que en la reacción entre una base y un ácido poliprótico la neutralización no es completa, en la sal formada quedaran disponibles protones ácidos que en disolución pueden conducir a la obtención de medios con un pH inferior a 7.
Clasificación de las sales
Entones, según lo que hemos visto hasta ahora, podemos clasificar de forma general las sales de dos formas.
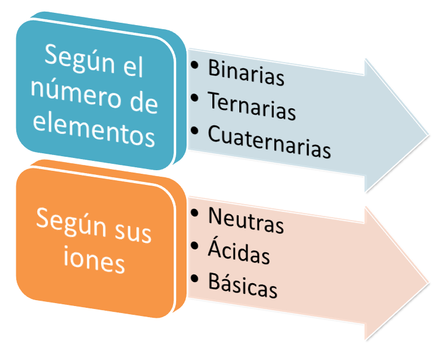
Clasificación de las sales. Fuente: @emiliomoron.
Importancia y aplicaciones de las sales
De forma general, todos tenemos conocimiento de la importancia de las sales, son básicas para el funcionamiento del metabolismo animal y vegetal. En el organismo las sales son el vehículo para aportar electrolitos como iones de sodio, potasio, magnesio, cinc y calcio entre otros, indispensables para la formación de tejidos y recuperación de estructuras orgánicas. Por lo que en la preparación de medicinas y alimentos han encontrado grandes aplicaciones.
Pero no para allí, hoy día las sales tienen una importancia tecnológica relevante, por citar la utilización de acuíferos altamente salinos para el secuestro del CO2 a grandes profundidades, una tecnología muy discutida en este momento, pero también podemos mencionar la explotación de salmueras para la obtención de metales pesados, actinidos y sales de litio[5], este último como sabemos tiene una gran demanda para la fabricación de baterías de litio, no solo para equipos móviles, sino también vehículos y muchas otras aplicaciones. Las sales también tienen algunas aplicaciones que resultan hoy día controversiales, como la utilización de antiguas minas de sal para almacenar desechos tóxicos o utilizar formaciones geológicas de sal para almacenar desechos nucleares[6].

Pilas de sal en el salar de Uyuni, Bolivia. Se estima una concentración promedio de 500 a 600 ppm de Li+/L en la salmuera. Fuente de la imagen: Wikimedia commons, imagen con licencia CC-BY-SA-2.5
Aunque algunas sales son incoloras o en polvo tienen un aspecto blanco como el cloruro de sodio, muchas otras sales exhiben llamativos colores, como el naranja del dicromato de potasio o al azul del sulfato de cobre; esta diferencia de colores se debe a las deformaciones que producen los electrones desapareados del elemento metálico en los orbitales atómicos, gracias a estas diferencias se utilizan una gran variedad de sales metálicas para producir y darle su atractivo a los fuegos artificiales, y también producir pigmentos de diferentes colores.

El color de los fuegos artificiales se explica con química y es gracias a las sales. Fuente: pixnio.com, imagen con licencia CC0.
Mediante la electrólisis de sales se pueden obtener y purificar muchos metales activos y otros compuestos de interés, por ejemplo, por medio de la electrolisis del cloruro de sodio se obtiene una disolución de hidróxido de sodio e hidrogeno (H2) y cloro (Cl2) de forma gaseosa; siendo este el proceso de mayor importancia comercial para obtener estas tres sustancias.
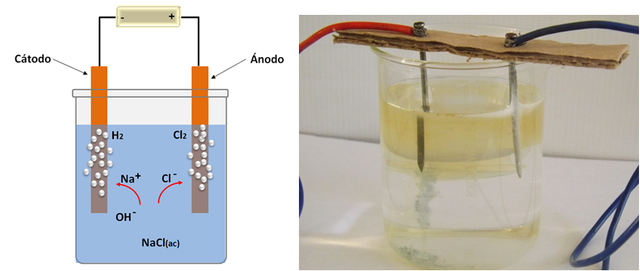
Electrólisis del cloruro de sodio, esquema que ilustra la celda (izquierda) y reacción (derecha), se puede observar en los electrodos el desprendimiento de burbujas (hidrógeno) y de un gas verdoso (cloro). Fuente: @emiliomoron.
Por ello, cualquiera que sea la aplicación, se requiere un conocimiento muy amplio de la solubilidad, el comportamiento de las fases y sus equilibrios en solución, así como de la cinética implicada para alcanzar estos equilibrios.
Referencias
- Wikipedia.com. Sal (química).
- Wikipedia.com. Cloruro de calcio
- Pymeslacteas.com Las alternativas al uso de sal en el queso
- Ecured.com Yoduro de sodio
- Voigt, W. (2011). Chemistry of salts in aqueous solutions: applications, experiments and theory. Pure Applied Chemistry, vol. 83, Nº5, pp: 1015-1030.
- Depósitos para residuos nucleares: ¿una utopía?

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
thank you very much for the constant support friends!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias amigos de Entropía!
Muy buena explicación en las diferentes formas de sal en lo que refiere a su clasificación y usos. Especialmente en la industria petrolera el uso de la sal es muy importante para la elaboración de fluidos de completación y fluidos de control para realizar trabajos de rehabilitación de pozos, en ese caso en particular la sal nos ayuda ya que es amigable y compatible con los fluidos de la formación, y aparte de eso tiene una solubilidad en al agua que nos permite incrementar y ajustar la densidad del fluido a utilizar para alcanzar una presión hidrostática que sostenga los fluidos como petróleo y gas natural en la formación.
Gracias por aportarnos tan valiosa información, que en mi caso particular me ayuda a recordar lo importante de este elemento. Saludos amigo @emiliomoron.
Saludos estimado @carlos84. Muchas gracias por complementar el contenido con tu comentario sobre su uso en la elaboración de los fluidos utilizados en los pozos, es una aplicación de la que no tenia conocimiento, estaré atento de leer al respecto. Me alegra que la información le haya sido útil, gracias a usted por pasar a leer.
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
many thanks friends!