Ácidos débiles en nuestra vida cotidiana. Características y donde encontrarlos
Saludos amigos de steemit y apreciados lectores.
En publicaciones pasadas describimos las características generales de los ácidos, y también describimos en otra las sustancias conocidas por su excesiva acidez, denominados superácidos; es por ello que quise ampliar el tema considerando ahora las sustancias conocidas como ácidos débiles, ya que estos forman parte de nuestra vida cotidiana y quizás pasan desapercibidos.
Seguro que la mayoría de nosotros asociamos el término ácido con líquidos sumamente peligrosos, y con toda razón si pensamos en los fuertes ácidos clorhídrico o sulfúrico; pero debemos saber que también hay algunos ácidos que en pequeñas concentraciones podemos consumirlos, incluso son beneficios para nuestra salud, estos pertenecen al grupo conocido como “ácidos débiles”. Sin embargo no hay que confundir el término “débil” con el cual se cataloga su acides con su reactividad, ya que si bien muchos de los ácidos débiles de origen orgánico forman parte de nuestra dieta, igualmente se debe moderar su concentración, y en el caso de los ácidos débiles de origen inorgánico, pues mejor huyamos de ellos. Esto quizás lo analicemos en otro post, por ahora quiero dedicar el presente a describir las características que le confieren el término “débil” a este grupo de ácidos y como forman parte de nuestra vida cotidiana.

La fortaleza de un ácido está asociada a su capacidad de ionización. Fuente: imagen editada por el autor, fuente original pixabay.com, con licencia Pixabay.
Empecemos por definir qué es un ácido débil
Un ácido débil es aquella sustancia que solo se disocia parcialmente en sus iones cuando forma parte de una disolución acuosa, en contraste con los ácidos fuertes, que se disocian completamente. Entonces, según la definición de Brönsted-Lowry para ácidos y bases, un ácido débil sería una sustancia con una pobre capacidad de donar protones en solución, o según la teoría de Arrhenius, es aquella con poca capacidad de producir iones hidronio, H+, en agua.
Por ejemplo, el ácido acético (componente del vinagre) es el ácido débil más conocido y con amplios usos en nuestro hogar, tiene como formula química CH3COOH; como ácido que es, ese último hidrogeno escrito en la formula puede ser cedido al agua cuando se forma una disolución, pero dada la poca polaridad de la molécula, no resulta tan fácil de hacer, de hecho es el solvente prótico con menor constante dieléctrica.
Lo que resulta en que solo una pequeña porción de las moléculas de ácido acético pueden ceder ese átomo de hidrogeno en forma de un ion hidronio, y a su vez, estas moléculas pueden arrancar este ion del agua, por lo que se establece un equilibrio en la solución con una concentración muy baja, pero constante, de iones H+. La reacción de ionización se escribe como:
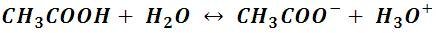
Como podemos observar se escribe una doble flecha en la ecuación química, la misma se utiliza para expresar que tanto la reacción directa como la inversa se producen y mantienen el sistema en equilibrio, por lo que establecido el equilibrio químico de la reacción, tanto el ácido, como su base conjugada y el ion hidronio están presentes en la solución acuosa. De forma general, la ionización de un ácido débil se representa como:
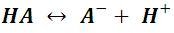
En la solución, aproximadamente un 1% de la concentración del ácido débil es capaz de producir iones hidronio.
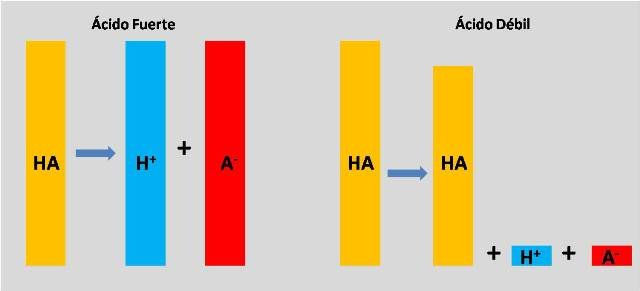
Entonces, ¿qué hace que la ionización sea parcial?
La ionización total o parcial de un ácido depende en gran medida de la polaridad o la distribución de los electrones al formarse un enlace químico. Cuando dos átomos que comparten electrones para formar un compuesto tienen valores cercanos de electronegatividad, los electrones se comparten de manera uniforme, pasando aproximadamente la misma cantidad de tiempo asociado a cada átomo (formando lo que se conoce como enlace no polar). Por otro lado, cuando la diferencia de electronegatividad entre los átomos es significativa, hay una separación de cargas producto de un reparto desigual de los electrones, donde estos son atraídos más hacia un átomo que al otro (formando el enlace polar).
Los átomos de hidrógeno tienen una ligera carga positiva al unirse a un átomo más electronegativo. Entonces, cuando hay una menor densidad electrónica asociada al hidrogeno es más fácil separarlo y de ionizar la molécula, haciéndola más ácida (es decir, generando un ácido fuerte). De este modo, los ácidos débiles se forman cuando no hay suficiente polaridad entre el átomo de hidrógeno y el otro átomo en el enlace para permitir que se separe con facilidad el ion hidrógeno.
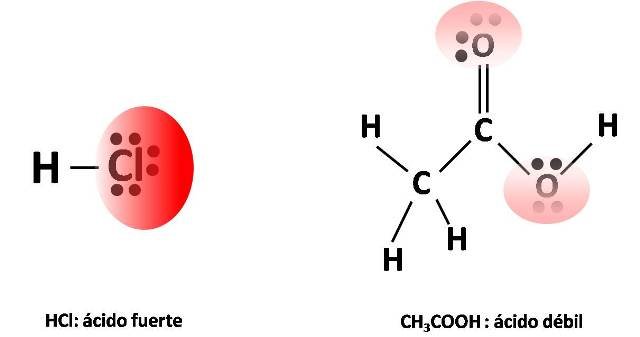
Densidad electrónica de un ácido fuerte y un ácido débil. Fuente: @emiliomoron.
Otro factor que influye en la fuerza de un ácido es el tamaño del átomo unido al hidrógeno. A medida que aumenta el tamaño del átomo, la fuerza del enlace entre los dos átomos disminuye. Esto facilita la ruptura del enlace para liberar el hidrógeno y aumenta la resistencia del ácido.
Otras características
Valores bajos de Ka y altos de pKa
Entonces, un ácido débil es uno que no se disocia completamente en solución; lo que significa que un ácido débil no dona todos sus iones hidrógeno, haciendo que tengan valores de constante de ionización ácida (Ka) muy pequeños en comparación con los ácidos fuertes, que tienen valores Ka muy grandes.
Si conocemos el pH de una disolución de un ácido débil y conocemos su concentración inicial, podemos estimar s constante de ionización. El procedimiento de cálculo se basa en estimar las concentraciones en el equilibrio, tal como lo hicimos en el post de una base débil.
Tomemos como ejemplo una disolución comercial de ácido acético, es decir vinagre, si leemos la etiqueta del producto observaremos que tiene una concentración expresada como 5%, si hacemos la conversión a molaridad, esto equivale a una concentración de 0,838 mol/L.

Concentración y pH del vinagre. Fuente: @emiliomoron.
Al medir el pH del vinagre observaremos que tiene un valor aproximado de 2,42; entonces, conociendo la concentración inicial de ácido y el pH, podemos determinar su constante de ionización de la siguiente forma:
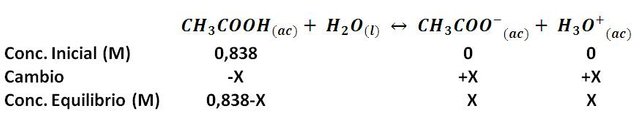
A partir de la definición de pH, se tiene que:
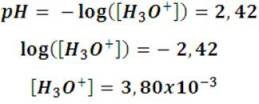
Y puesto que en el equilibrio la concentración de iones hidrógeno es igual a la concentración de iones acetato, podemos calcular el valor de la constante de la siguiente forma:
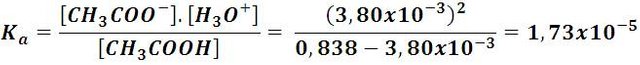
Como vemos, el valor de Ka en los ácidos débiles puede ser bastante bajo, todos tienen valores muy por debajo de 1, en contrasten con los ácidos fuertes cuyas constantes son tan grandes que se consideran infinitas, y solo se reportan en la literatura la de los ácidos débiles.
Debido al orden de magnitud de los valores de Ka, se suele expresar la fortaleza de los ácidos con una constante denominada pKa, la cual es una medida logarítmica de la constante de ionización ácida:
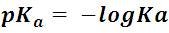
Para el ejemplo del ácido acético, obtendríamos un valor de pKa aproximadamente igual a 1. Para las soluciones acuosas de ácidos débiles los valores medibles de pKa varían desde aproximadamente -2 hasta 12 para un ácido extremadamente débil. El pKa para los ácidos fuertes se estima a partir de modelos teóricos y tiene valores por debajo de -2. Para tener una idea, el ácido clorhídrico tiene un valor de pKa igual a -9,3. Entonces, mientras más negativo es el pKa más fuerte es el ácido.
Ya habíamos comentado que el pH para las soluciones ácidas tienen valores menores a 7, por lo que se esperaría que mientras más fuerte sea un ácido más bajo sea su valor de pH, y aquellas soluciones que tengan un pH moderado resulten de los ácidos débiles. En la siguiente imagen podemos observar el pH de algunas sustancias que consumimos con frecuencia.
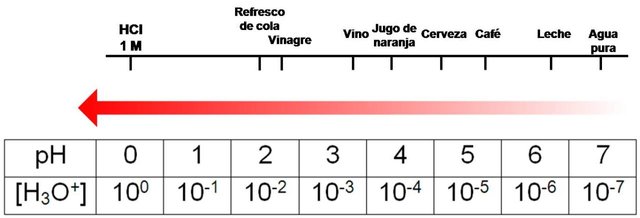
pH de algunas sustancias comunes. Fuente: tomada de Chemistry Libre Texts, lebreria con licencia CC BY-NC-SA 3.0, y adapatada por el autor.
Efecto inductivo
Los efectos inductivos y resonantes son los responsables de la acidez de los compuestos orgánicos, mientras más voluminoso sea el grupo alquilo de los ácidos resulta más difícil de solvatar, dando menor estabilización al sustituyente dador o aceptor de electrones, disminuyendo la acidez.
Dependiendo de la configuración de los átomos en la molécula, algunos isómeros de una sustancia son más ácidos que otras. El efecto inductivo produce que el átomo de hidrógeno no requiera estar enlazado directamente al elemento electronegativo para que un compuesto tenga mayor o menor acidez.
Algunos ejemplos de ácidos débiles y donde los encontramos
La gran mayoría de los ácidos son débiles, en especial los ácidos de origen orgánico, y están presentes en muchas sustancias y productos que utilizamos o consumimos a diario. Entre ellas podemos citar como ejemplo las siguientes:
Ácidos inorgánicos
Muchos productos de uso común tienen componentes que son ácidos débiles, entre ellos se encuentran:
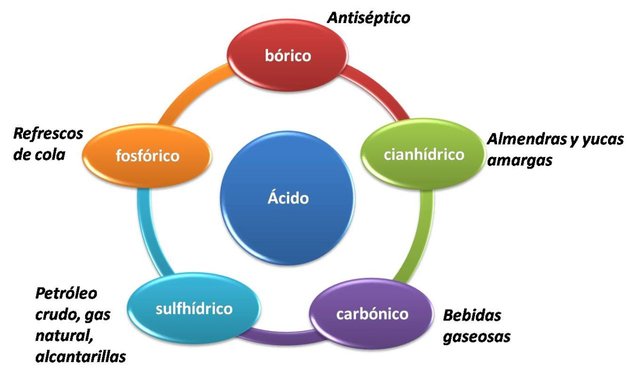
Productos comunes en el hogar que presentan ácidos débiles. Fuente: @emiliomoron.
El ácido bórico es bastante conocido ya que es uno de los pocos ácidos que podemos encontrar de forma sólida en presentaciones comerciales, se utiliza comúnmente en productos farmacéuticos y de uso personal como antiséptico, también como insecticida ya que provoca una lenta deshidratación de insectos como hormigas, cucarachas y termitas.
El ácido sulfhídrico esta contenido de forma natural en el petróleo y el gas, también se forma durante la descomposición bacteriana de la materia orgánica. En su forma gaseosa se le reconoce por su olor a huevos podridos, y es altamente toxico, 20 ppm son suficientes para causar desde molestias agudas hasta la muerte por exposición prolongada, los trabajadores petroleros deben conocerlo muy bien, ya que según el área de trabajo corren el riesgo de exposición. De otra forma quizás lo hayamos notado al pasar cerca de una alcantarilla destapada, percibiendo su desagradable olor.
El ácido carbónico es un oxácido utilizado muy frecuentemente para aportar sabor y acidez a los alimentos, y junto con el ácido fosfórico, están presentes en todas las bebidas gaseosas o carbonatadas.
El cianuro de hidrogeno, si bien es un compuesto ligeramente ácido, resulta altamente venenoso. En forma gaseosa, una concentración de 300 ppm es suficiente para ser mortal. Algunas frutas como almendras amargas y albaricoques tienen una pequeña concentración de este ácido en su semilla, también una variedad de yuca conocida como “yuca amarga”, quizás muchos hayamos escuchado de desenlaces fatales por su consumo accidental.
Ácidos orgánicos
La gran mayoría de ácidos débiles son de origen orgánico, algunos de ellos son:
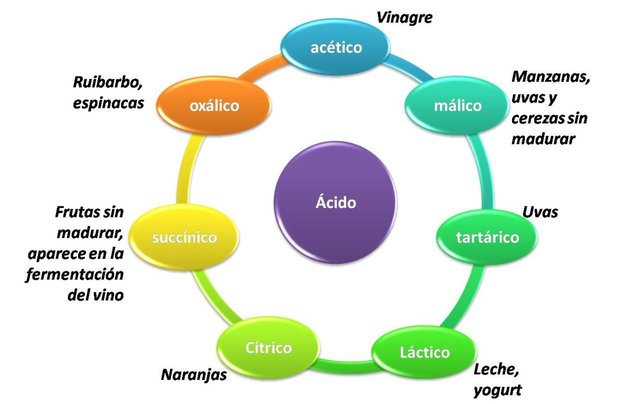
Presencia de ácidos débiles en los alimentos. Fuente: @emiliomoron.
El ácido acético, o ácido etanoico según su nomenclatura IUPAC, tiene múltiples usos, es un reactivo muy común en los laboratorios de química, en la industria se emplea en la fabricación de plásticos, pigmentos y solventes. En concentraciones bajas lo utilizamos comúnmente en el hogar en su presentación comercial conocida como vinagre, mayormente como saborizante y conservante de alimentos. Conservar vegetales y carnes con vinagre los conserva porque el ácido acético previene el crecimiento bacteriano. Además, algunos detergentes y lavaplatos suelen contener ácido acético, incluso también se ha usado como insecticida y para controlar infecciones fúngicas. Pero no se confíen, en bajas concentraciones no es perjudicial como a altas concentraciones.
El ácido málico es ácido dicarboxílico muy abundantes en la naturaleza, siendo el responsable del sabor ácido y el color verde de algunas frutas como manzanas y uvas sin madurar. Este ácido es my importante para el organismo, es sintetizado por el organismo para producir carbohidratos y energía, y participa en la obtención del adenosín trifosfato (ATP), asociándose la deficiencia del consumo del mismo como un factor para desarrollar fibromialgia. En la industria farmacéutica es muy utilizado para la fabricación de laxantes, además de encontrarlos en frutas y verduras, artificialmente se incorpora en la alimentación como aditivo acidulante de bebidas gaseosas, y también aparece durante la fermentación del vino.
El ácido tartárico se consigue en forma libre y combinada en las uvas, por lo que su consumo principalmente proviene de esta fruta, de otra forma se puede consumir como acidulante y conservante artificial de bebidas y alimentos, y al tomar vinos, ya que se utiliza para corregir su acidez.
El ácido láctico lo encontramos en carnes y lácteos, forma parte de los músculos y algunos órganos de plantas y animales, es muy común escuchar entre deportistas que su producción metabólica durante el ejercicio intenso sea la responsable de los dolores musculares. De forma aislada puede obtenerse a partir de la lactosa (el azúcar de la leche) y utilizarse como regulador de acidez de alimentos, en formulación de alimentos para niños y como materia prima para biopolimeros.
El ácido propiónico y sus sales se pueden conseguir como agentes saborizante en algunos alimentos. Antiguamente se utilizaba para utilizaba en el pan y productos horneados, para inhibir el crecimiento de moho, actualmente se utiliza con el mismo propósito en quesos. Su uso en una variedad de productos ha ido en aumento, especialmente las industrias farmacéutica y de alimentos. Las concentraciones típicas en los alimentos son de 0,4 por ciento o menos.
En conclusión
Los ácidos débiles, tanto orgánicos como los inorgánicos se, encuentran abundantemente en nuestro alrededor; en los sistemas naturales desempeñan funciones muy variadas, desde metabolitos intermediarios hasta componentes de sistemas amortiguadores o buffer. Muchos se encuentran contenidos de forma natural en los alimentos, y otros son añadidos de forma artificial para dar sabor o conservarlos; pero siempre en bajas concentraciones, nunca confundamos el término débil con inofensivo, ya que, si bien nos podemos beneficiar de muchas de sus funciones, estos compuestos no dejan de lado su naturaleza ácida, y en altas concentraciones resultan peligrosos.

Referencias:
Constante de disociación ácida


¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Interesante información, es útil conocer estos detalles sobre los ácidos débiles muchos de los cuales están presentes en nuestra alimentación, explicas con detalle a nivel molecular, no es mi área de conocimiento aún así me parece un excelente post, saludos @emiliomoron.
Saludos amigo ydavgonzalez. Gracias por tu apreciación del post, ciertamente es útil conocer algunos detalles sobres las sustancias que consumimos con frecuencia, como en esta caso sobre los ácidos débiles que se encuentran en muchos alimentos. Me alegra que encontraras interesante la información. Nos seguimos leyendo!
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Muchas gracias!
Un post muy bien documentado y explicado. Aunque no es mi área de conocimiento agradezco un mundo que nos empoderes de esta información... De veras me ha sido útil conocer esta temática
Saludos @yrmaleza. Me alegra que la información te haya sido útil, aprecio tu comentario y espero poder seguir llevando este tipo de contenido. Nos seguimos leyendo.
Emilio, muy graciosa tu imagen inicial😄 Me encanta poder leer este tipo de contenidos en la plataforma... Aunque no sea nuestra área de conocimiento, valoro mucho que nos empoderes de una información tan útil y versátil a la vez. Te aplaudo y ánimo a continuar trayéndonos temas igual de interesantes
Hola @talmid. Me alegra que te gustara, es un gusto compartir la información, espero seguir haciendo temas que les gusten a todos, conocedores o no de la materia. Saludos y gracias por leer!