Fundamentos de Cinética Química: Reacciones Ordinarias y Secuenciales de Primer Orden

En el universo está ocurriendo constantemente millones de reacciones químicas, cada una de ellas son indispensables para el funcionamiento de diferentes sistemas tanto físicos como biológicos. Comúnmente en la química observamos reacciones de gran impacto que impresionan nuestros sentidos, muchas de ellas inclusos asustan, debido a la peligrosidad, bien sea por liberación de energía o por la toxicología de los reactivos. Aunque sabemos que todas estas reacciones pueden ocurrir, utilizando datos termodinámicos como la energía libre de Gibbs, es la cinética la que realmente nos proporciona la información necesaria para cuantificar de forma teoría y experimental, que tan rápida es una reacción, como son sus intermediarios, y en cuanto tiempo se podría decir que la reacción ha “finalizado”. En este artículo, se resaltarán los aspectos básicos de esta rama de la fisicoquímica que modela la dependencia temporal de este tipo de fenómenos.
Dada una reacción química general, se tiene que:

Se puede definir la velocidad de reacción, como la tasa de cambio de los moles de una especia involucrada del sistema en función del tiempo. Dado que las reacciones químicas tienen una estequiometria asociada, entre mayor sea el numero estequiométrico con respecto a las demás especies químicas, menor será su velocidad de “desaparición” o de “aparición”:
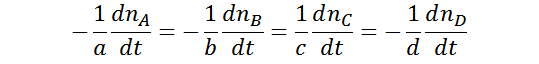
Un ejemplo de esto, es la siguiente reacción:
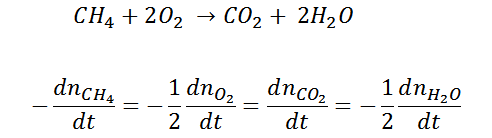
Es importante destacar que, se coloca un signo negativo, como convención, para indicar que dicha especie química se esta consumiendo en el tiempo, es decir que el número de moles decaerá con el pasar del tiempo. Según el ejemplo anterior, se puede interpretar que la velocidad de desaparición del metano es el doble que la del oxígeno, o de otra forma, la velocidad de desaparición del oxigeno es el doble que la del metano, y esto sucede precisamente por el requerimiento estequiométrico de la reacción 1:2. Análogamente se interpreta como velocidad positiva, la de aquellas especies químicas (productos), cuyas concentraciones o cantidad de moles aumenten con el transcurso de la reacción.
Dicho de esta forma, la velocidad de reacción es una propiedad extensiva, que depende de la cantidad de materia (moles). Se puede considerar una velocidad de reacción intensiva, la cual depende de la concentración de la especia en cuestión, esta ultima forma es mucho más útil a nivel experimental, ya que se pueden utilizar métodos espectroscópicos para evaluar las concentraciones de las especies químicas involucradas en función del tiempo.
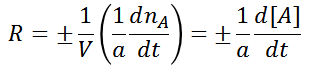
Por lo tanto, también podemos asociar la velocidad de reacción como el cambio de concentración de un reactivo en función del tiempo, relativo a su número estequiométrico.
)
En todos los campos de la química, el estudio de la cinética es sumamente importante para estudiar el comportamiento de las reacciones, en aplicaciones medicas o industriales, es conveniente saber la dependencia de uno o de todos los reactivos con la velocidad de reacción, o la contribución de cada una de las concentraciones iniciales, al valor de la velocidad total. Considero este apartado una de las utilidades cotidianas de la ingeniería química, donde se pretende optimizar una reacción conocida (y sabiendo que es termodinámicamente favorable), para que ocurra en el menor tiempo posible, ahorrando así gastos económicos, energéticos, y claro, ahorrando tiempo.
No solo en la parte industrial es importante estudiar esto, para la química farmacéutica y/o bioquímica, estudiar el avance de la biodisponibilidad de algún principio activo, que esta actuando como droga en algún organismo, es de crucial importancia para obtener conclusiones congruentes con su efecto farmacológico.

La ley de velocidades es expresada de la siguiente manera:

Se observa el producto de las concentraciones de los reactantes, elevados a una constante, y otra constante k, la cual es una constante de proporcionalidad característica de una reacción en unos valores de temperatura y presión dados. Los exponentes de cada una de las concentraciones son determinados experimentalmente. Se dice que una reacción es de orden “𝛼” con respecto a “A”, de orden “𝛽” con respecto a “B”, y de orden global “𝛼 + 𝛽”, si se cumple lo anteriormente descrito.
Como se menciono anteriormente estas constantes son determinadas experimentalmente. Usualmente se utilizan el método del aislamiento: En el cual todas las especies se mantienen a elevada concentración con respecto a una especia que debe estar muy diluida. En este caso la variación de las concentraciones de las especies concentradas se pudiera asumir como despreciable, obteniendo una velocidad inicial dependiente casi por completo de la especie diluida, de esta forma se puede calcular el orden de dicho reactivo de forma aproximada.
Otro método conveniente para su obtención, es realizar la medida de la variación de concentración de una especie en el tiempo dos veces, en la cual la única diferencia será la concentración inicial de solo uno de los reactantes, mediante una relación de los valores de R, también se puede obtener un valor bastante aproximado de el orden para dicho compuesto.
Un ejemplo de este método se muestra a continuación:
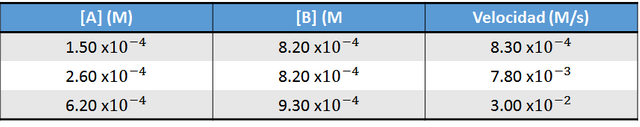
En la tabla anterior se observa como en las replicas 1 y 2, la concentración de la especia dos es la misma, por lo tanto, al hacer una relación con los datos experimentales se puede llegar a la siguiente expresión:
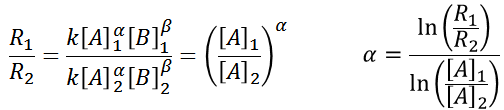
De esta forma se puede calcular el orden de la reacción con respecto a A, y al ser una reacción sencilla de solo 2 reactantes, el cálculo de él orden de reacción con respecto a B, puede ser realizado sin problema, de forma análoga. Una vez obtenidos ambos ordenes, se conoce finalmente el orden global de la reacción y se puede plantear la expresión de velocidad asociada.
Usualmente se pueden obtener expresiones no diferenciales de las concentraciones de las diferentes especies. Esta aproximación matemática permite conocer la evolución de estas variables en función del tiempo, incluyendo las constantes de velocidad asociadas a cada paso de mecanismo propuesto. De esta forma, para una reacción ordinaria de primer orden se tiene lo siguiente:

Siendo su expresión de velocidad
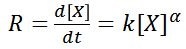
La cual puede ser interpretada como una ecuación diferencial y resolverse mediante el método de separación de variables

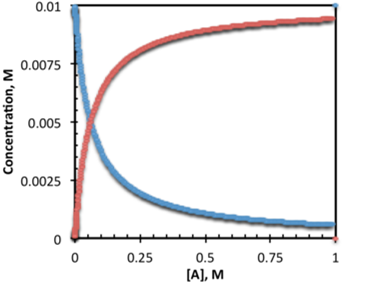
De esta expresión, se obtiene el comportamiento de la concentración inicial de un reactante X, con forma de decaimiento exponencial, comportamiento que es congruente con lo observado experimentalmente para las reacciones de orden 1. Si se quisiera conocer la evolución, en otras palabras, la aparición del producto, se puede plantear lo siguiente:
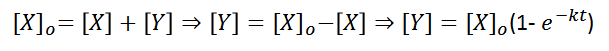
En este caso se obtiene la expresión que modela matemáticamente la aparición del producto Y en función del tiempo.

En algunos casos, las reacciones pueden ser secuenciales. Esto sucede cuando se plantea un mecanismo de varios pasos o que incluye intermediarios asociados a cada uno de los pasos. Para estudiar este tipo de reacciones es necesario partir de la ley de velocidad para cada una de las especies.
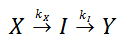
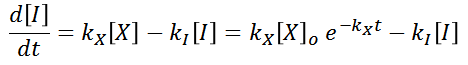
La ecuación diferencial presentada anteriormente, se puede resolver para hallar la siguiente solución para la concentración del intermediario I
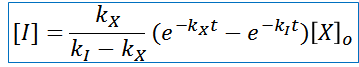
Al ser los intermediarios de gran interés químico para el estudio o confirmación experimental de un mecanismo de reacción propuesto, se procederá a deducir la función que describe el comportamiento de su concentración en el tiempo:
Demostracion:
Al ser una ecuación diferencial ordinaria de primer orden, se procederá a encontrar la solución a la ecuación homogénea
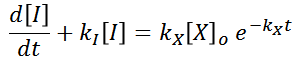
Para ello, buscaremos las raíces del polinomio característico asociado a la ecuacion
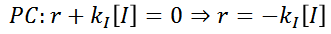
Una vez obtenidas las raíces, se propone como solución a la ecuación diferencial homogénea la siguiente expresión
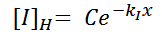
Una vez encontrada la solución homogénea, se necesita propones una solución general que satisfaga la igualdad original
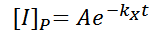
Esta solución propuesta, se derivara cuantas veces sea necesario para poder sustituirla en la expresión inicial, y poder hallar el coeficiente A.
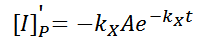
Sustituyendo:
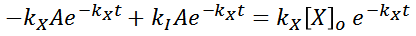
Por lo tanto el coeficiente A es
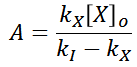
Y se tiene como solución general a la concentración de I ([I]), la siguiente familia de funciones
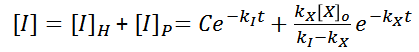
Sin embargo, es necesario conocer la solución particular a este problema, para ello es necesario determinar el valor de la constante C en la solución general. Para lograrlo, se usara el valor inicial de la concentración de I en un tiempo igual a 0, es decir, cuando aun no ha comenzado la reacción… Al ser I, una especie intermediara, se tiene lo siguiente
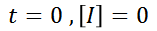
Sustituyendo esta condición, se puede hallar C facilmente
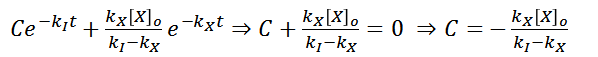
Por lo tanto la solución general de la ecuación propuesta es
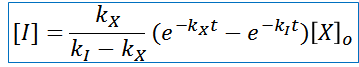
Si se desea conocer la concentración del producto en función del tiempo, solo basta con sustituir las expresiones necesarias en la siguiente igualdad

En este sentido se ha logrado resolver una ecuación diferencial de primer orden, que nos permite conocer la concentración del intermediario (o intermediarios) en función del tiempo, conociendo cada una de las constantes de velocidad asociada a cada paso.
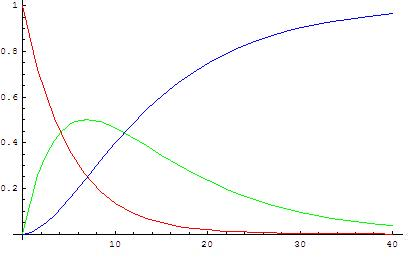
Esto ha sido todo por hoy, espero que hayan disfrutado el contenido del post, personalmente creo que la cinética es un área fundamental para muchas disciplinas más allá de la química, cualquier comentario será bienvenido (dudas, sugerencias, etc.). Pronto espero realizar la segunda parte acerca de las reacciones de segundo orden y equilibrios.
Seguimos a la espera de los grandes desarrollos que nos traerá el futuro, tú decides si ser espectador o realizador. Todos los días podemos aprender algo nuevo.
Gracias por leer.
Referencias:
Todas las imágenes y sepradores de mi autoría, fueron editados y procesados utilizando el programa PowerPoint 2016.
- Theodore Brown, Eugene LeMay, Bruce Bursten, Julia Burdge, (2004), Quimica. La ciencia central. (9° Edición). Pearson Educación, S.A.
Douglas Skoog, Donald West y James Holler (2006) Fundamentos de Química Analítica (4ta Edición) Editorial Reverté.
CRC HandBook of Chemistry and Physics, 86th Edition, CRC Press 2005
Arthur I. Vogel et al. (1989) Textbook of Quantitative Chemical Analysis, 5th edition, Longman Scientific & Technical.
Engel, Thomas, and Philip Reid. 2006. Physical chemistry. San Francisco: Pearson Benjamin Cummings.

Posted from my blog with SteemPress : http://aleestra.vornix.blog/fundamentos-de-cinetica-quimica-reacciones-ordinarias-y-secuenciales-de-primer-orden/
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Muchas gracias por su apoyo @entropia
Hola @aleestra, muy interesante tu aporte relacionado con las reacciones químicas, no soy muy experta en esta materia, sin embargo me llama la atención que en tus reflexiones iniciales te refieres a los cuidados que hay que tener con las mismas por los riesgos que algunas de éstas conllevan, imagino que se trata cuando se experimenta por primera vez con un elemento o compuesto poco conocido del cual se desconocen sus niveles de volatilidad y toxicología, deben ser riesgos parecidos a los que enfrentó Marie Curie. Ahora bien, me pregunto si en la actualidad existen avances tecnológicos que permitan estudiar las reacciones químicas tanto de elementos conocidos como desconocidos sin que se corran riesgos de alto nivel? Muy bueno tu aporte, saludos fraternos!!
Hola @reinaseq, nuevamente gracias por su comentario. Como bien comenta, Marie Curie fue gravemente afectada, en ese caso por radiación. Hoy en día aun existen casos de accidentes químicos en laboratorios e industrias. La peligrosidad puede varias desde incendios, explosiones, generación de calor en exceso, hasta riesgos biológicos; y aunque han sido controlados en gran medida en los últimos años, aun existe la posibilidad de que sucedan. La química teórica permite predecir en gran medida si una reacción puede ocurrir o no, sin embargo la cinética nos proporciona una idea de que tan rápido puede ocurrir, si bien se puede proponer un mecanismo teórico, siempre es necesario compararlo con la realidad, ya que una gran cantidad de reacciones contemplan uno o mas intermediarios, y estas especies son difíciles de estudiar porque tu tiempo de vida es extremadamente corto. Aun así, han habido avances importantes en los modelos teóricos y estoy seguro que seguirán habiendo :)
Saludos @aleestra, sin duda que la cinética química es un área muy importante de la química, si bien la termodinamica nos permite estudiar los equilibrios a fin de determinar la cantidad de producto nos permite establecer que tan rápido se obtiene, y con ello, industrialmente hablando, poder establecer si es rentable una operación. Muy buen aporte desde el punto de vista de la demostración, es buen recurso para los estdiantes que requieren concer como solucionar ecuaciones cinéticas. Saludos!
Hola, muchas gracias nuevamente por tu comentario. Efectivamente es la cinética una rama importante para el estudio de los mecanismos y me alegro mucho de poder estudiarlas después de tanto tiempo esperándolo. Decidí hacer la demostración porque en los libros que he estado utilizando no se encuentra la solución paso a paso, así que me pareció importante para las personas que deseen profundizar en el campo matemático aplicado a la química. Estamos en contacto, saludos.