Primera ley de termodinámica. La energía interna
Experimentos de Joule
Durante los años 1840 a 1878 J. P. Joule llevó a cabo una serie de experimentos cuidadosos sobre la naturaleza del trabajo y el calor. Estos experimentos son fundamentales para comprender la primera ley de la termodinámica y el concepto moderno de la energía. En esencia, los experimentos de Joule fueron bastante simples, pero tomó muchas precauciones para garantizar la precisión. En su famosa serie de mediciones, Joule colocó cantidades conocidas de agua en un contenedor aislado y agitó el agua con un agitador rotatorio. La cantidad de trabajo realizado en el agua por el agitador se midió con precisión, registrando cuidadosamente los cambios en la temperatura del agua. Joule descubrió que se necesitaba una cantidad fija de trabajo por unidad de masa de agua por cada grado de aumento de la temperatura provocado por el agitador, y que la temperatura original del agua podía restablecerse mediante la transferencia de calor mediante el simple contacto con un objeto más frío . Así es como Joule demostró de forma concluyente la existencia de una relación cuantitativa entre el trabajo y el calor y, en consecuencia, que el calor es una forma de energía.

Energía interna
En experimentos como los llevados a cabo por Joule, la energía se agrega al agua como trabajo, pero se extrae de ella en forma de calor. Esto plantea la pregunta de qué le sucede a la energía entre el momento en que se agrega al agua como trabajo y cuando se extrae en forma de calor. La lógica sugiere que esta energía está contenida en el agua, en otra forma, que se define como energía interna. El término se refiere a la energía de las moléculas que componen la sustancia, que están en un movimiento continuo y tienen energía cinética de traslación, con la excepción de las moléculas monoatómicas que también tienen energía cinética de rotación y vibración interna. La adición de calor a la sustancia aumenta esta actividad molecular, causando un aumento en la energía interna. El trabajo realizado sobre la sustancia puede tener el mismo efecto, como se demostró Joule.
La energía interna de una sustancia también incluye la energía potencial resultante de las fuerzas intermoleculares. En la escala submolecular, hay una energía asociada con los electrones y núcleos de los átomos, así como una energía de enlace resultante de las fuerzas que mantienen unidos a los átomos como moléculas. La designación de esta forma de energía como interna la distingue de la energía cinética y potencial que una sustancia puede tener como resultado de su posición o movimiento macroscópico, y que puede considerarse como formas externas de energía.

Primera ley de la termodinámica
El reconocimiento del calor y la energía interna como formas de energía sugiere una generalización de la ley de conservación de la energía mecánica para aplicarla al calor y la energía interna, así como al trabajo y a la energía cinética y potencial externa. Por otro lado, la generalización puede extenderse a otras formas de energía, como la energía de superficie, la energía eléctrica y la energía magnética. Al principio, esta generalización fue solo un postulado, pero sin excepción todas las observaciones hechas en procesos ordinarios lo respaldan. Por lo tanto, el postulado ha alcanzado el estado de ley de la naturaleza y se conoce como la primera ley de la termodinámica. Un acercamiento formal a esto es:
Aunque la energía toma muchas formas, la cantidad total de energía es constante, y cuando la energía desaparece en una forma, aparece simultáneamente en otras formas.
Un claro ejemplo de la primera ley de la termodinámica es la famosa ecuación de Einstein para procesos de reacción nuclear, donde C es la velocidad de la luz. Aquí, la masa se transforma en energía, y las leyes de conservación de la masa y la energía se combinan para establecer que la masa y la energía se conservan juntas.
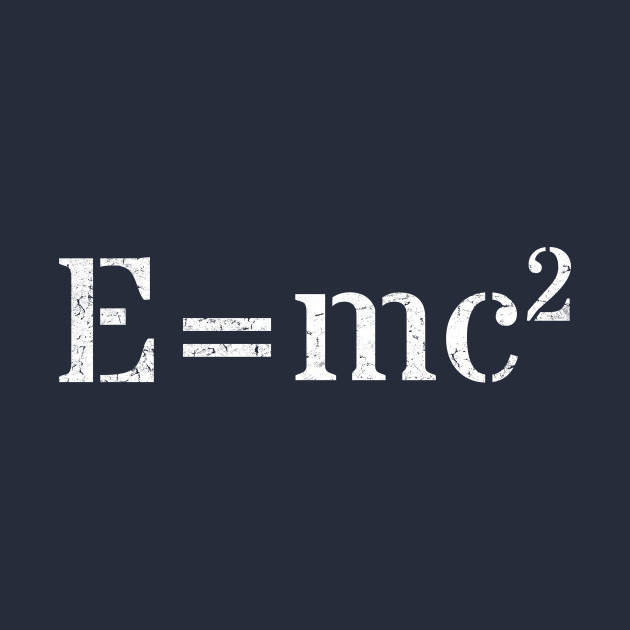
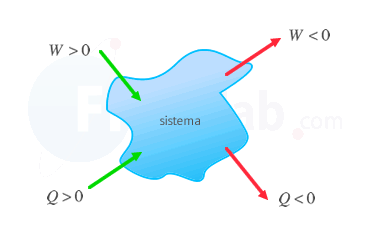
La primera ley de la termodinámica establece una relación entre la energía interna del sistema y la energía que intercambia con el medio ambiente en forma de calor o trabajo.
La primera ley de la termodinámica determina que la energía interna de un sistema aumenta cuando se transfiere calor o se realiza un trabajo en él.
Como todos los principios de la termodinámica, el primer principio se basa en sistemas de equilibrio. Por otro lado, es probable que hayas escuchado más de una vez que la energía no se crea ni se destruye, solo transforma lo que trato en mi publicación anterior. Es el principio general de la conservación de la energía. Bueno, la primera ley de la termodinámica es la aplicación a los procesos térmicos de este principio. En un sistema aislado, en el que la energía no se intercambia con el exterior, tenemos:

Si el límite de un sistema no permite el transporte de materia entre el sistema y su entorno, entonces se dice que el sistema está cerrado y la masa es constante. En este caso, no puede haber transporte de energía interno a través del límite del sistema. Todo el intercambio de energía entre un sistema y su entorno se realiza como calor y trabajo, y el cambio en la energía total del entorno es igual a la energía neta transferida hacia o desde él como calor y trabajo. El segundo término de la ecuación puede, por lo tanto, ser reemplazado por:

Donde:
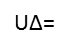 = Diferencial de energia interna
= Diferencial de energia interna
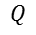 = Calor
= Calor
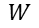 = Trabajo
= Trabajo
Hola @
Bienvenida a esta comunidad científica que escribe en español.
Te recomiendo leer el post:
https://steemit.com/spanish/@carloserp-2000/steemstem-invita-a-la-comunidad-de-habla-hispana-a-publicar-articulos-cientificos
Encarecidamente hay que cumplir ciertos criterios para valorar tu post, y así aprovechar más tu potencial para transmitir tus ideas, tus conocimientos en estos temas tan interesantes de la ciencia.
Estaremos pendiente de tus futuras contribuciones.
Específicamente me podrías indicar en qué aspecto es que estoy fallando