
Tubos de ensayo con soluciones. Ref Pixabay.
La valoración ácido-base es una técnica analítica en la que se mide cualitativamente la capacidad de una sustancia para reaccionar con un reactivo específico basado en la estequiometría de la reacción y la cantidad del reactivo específico. Para realizar estos cálculos tomamos la referencia del punto donde el indicador líquido comienza a cambiar de color llamado punto final, a diferencia del punto de equivalencia en que el punto donde el titulador reacciona completamente con el analito, el punto final está determinado por el pH de la solución, en la Figura 1, muestra una curva de pH versus volumen (mL) de una titulación con fenolftaleína como indicador, se aprecian el punto final y el punto de equivalencia. Cuando se tiene una reacción en la que la equivalencia de los reactivos es 1: 1, entonces el número de moles de la especie reactiva A se consumirá con la misma cantidad de moles de la especie B. Entonces:
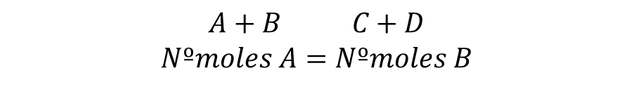
Sabiendo eso para compuestos en solución:
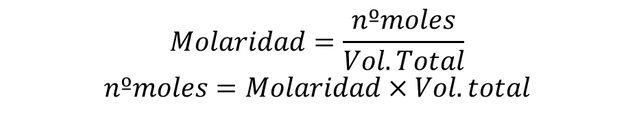
Entonces
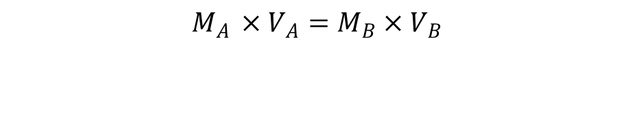
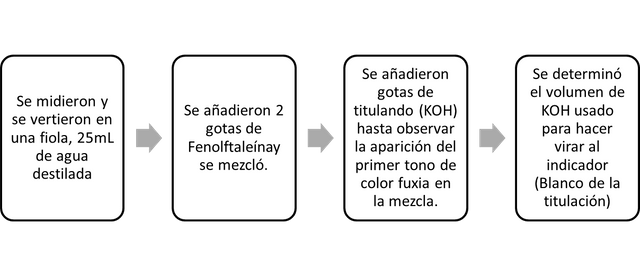
Para realizar una titulación de manera adecuada, se debe tener en cuenta el uso y la determinación de la titulación; Este es el volumen de titulante requerido para encender el indicador cuando solo está en presencia del solvente (agua destilada). Las valoraciones posteriores deben restarse de este volumen ya que estamos interesados en el volumen del titulador que reaccionó con el analito. También debemos tener en cuenta el error de la titulación: la diferencia entre el punto de equivalencia y el punto final, y se calcula de la siguiente manera:
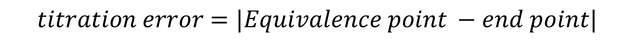
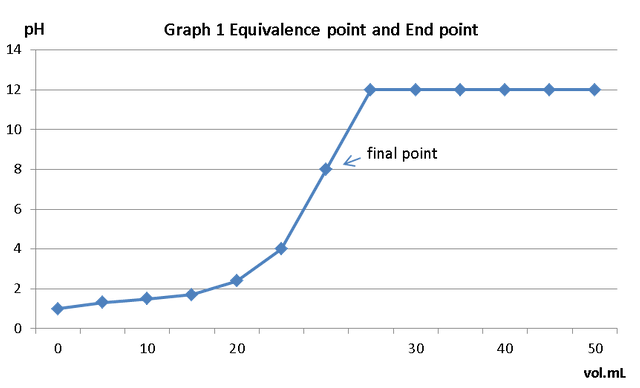
Figura 1 . Valoración con fenolftaleína como indicador.
En este punto, adjunte los errores de los instrumentos, por ejemplo, 0.07mL, que arrojaron el resultado del error de la bureta más la apreciación de cada gota.
OBJETIVOS:
•Prepare una solución de HCl 0,1 M a partir de una solución comercial de HCl.
• Valorar una solución de 0.1M HCl con una solución estandarizada 0.1M y fenolftaleína como indicador mediante la determinación previa del objetivo de titulación.
• Determine la concentración de hidróxido de potasio en una muestra de ensayo utilizando la solución de ácido clorhídrico preparada anteriormente como solución estándar (o valorante).
MATERIALES UTILIZADOS:
• 2 Vaso de precipitados de 250 ml.
• Cilindro graduado de 10mL.
• 1 bola graduada de 500mL.
• Pipeta volumétrica de 25 ml.
• Bureta de 50 ml.
• Fenolftaleína.
• Soluciones 0.1M de:
o Hidróxido de potasio (KOH)
o HCl 37% p / p, d = 1,19 g / mL
Procedimiento experimental
Experiencia 1:
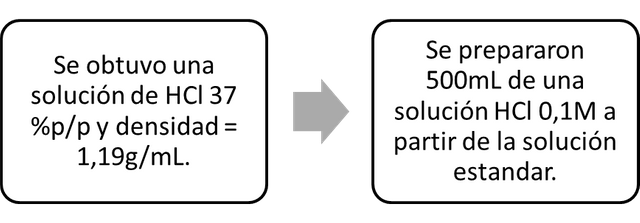
- Parte A. Preparación de una solución de 0.1 M de HCl.
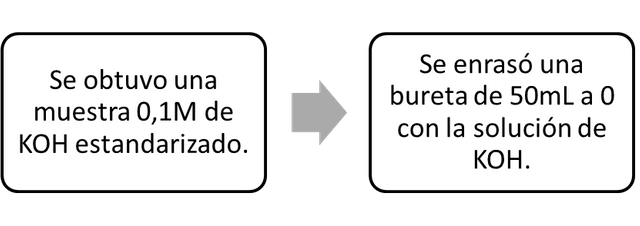
- Part B. Preparación de la bureta de valoración.
- Part C. Determinación del objetivo de la titulación.
- Parte D. Valoración de la solución HCL aproximada.
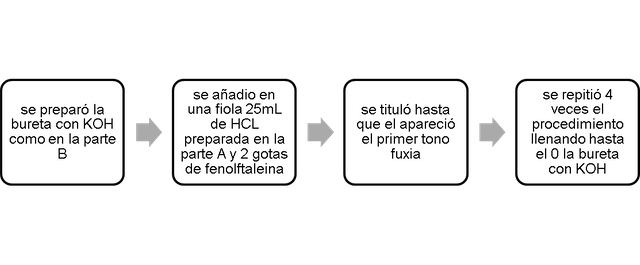
Experiencia 2. Valoración de una muestra del problema de KOH.
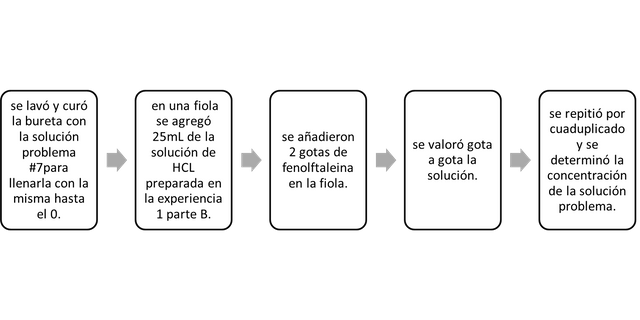
Datos recolectados y discusiones.
Experiencia 1.
Table 1. Preparación de una solución 0,1 M de HCl.
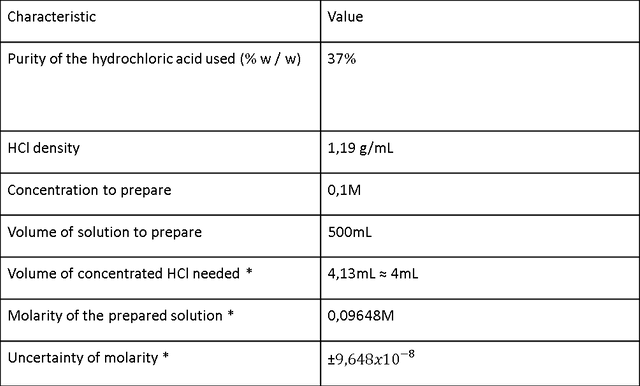
La Tabla 1 muestra los resultados obtenidos cuando se prepara una solución 0,1 M de HCl a partir de una solución estándar de HCl. Los cálculos matemáticos se llevaron a cabo en los que se obtuvo la cantidad necesaria de HCl para preparar una solución 0.1M, que era un volumen de 4.13mL ≈ 4mL, luego se realizaron los cálculos de molaridad. la solución preparada y estos dieron un valor de (0.09648 ± 9.648x 〖 10〗 ^ (- 8)) M. Podría decirse que la solución fue de aproximadamente 0.1M
.
Tabla 2 Características de la titulación de HCl.
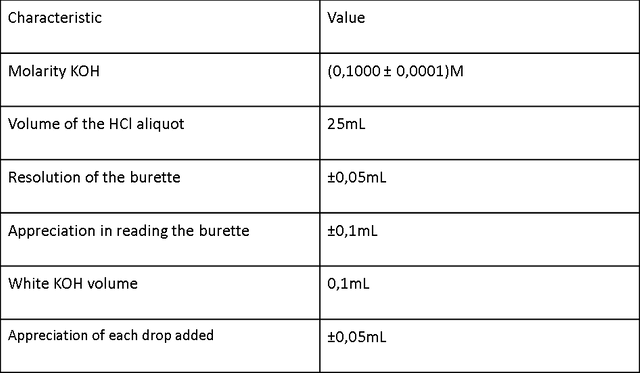
Tabla 2.1 Volúmenes de KOH utilizados para la titulación de HCl.
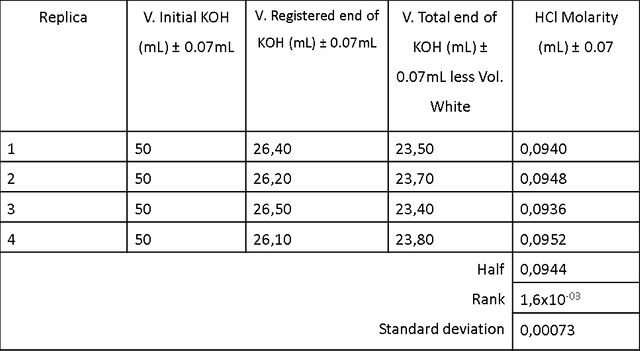
La Tabla 2 muestra las características de los compuestos usados para valorar una solución preparada de HCl con una solución de KOH estándar de (0.1000 ± 0.0001) M y la Tabla 2.1 muestra los resultados de los volúmenes de KOH agregados para 4 valoraciones de 25 ml de una solución preparada de HCl . Los volúmenes registrados corresponden a los volúmenes necesarios para alcanzar el punto final de la valoración por la presencia de fenolftaleína como indicador en el medio (el rango de variación es: incoloro <8.0 - Rosa> 10.0). La reacción química entre HCl y KOH se rige por la siguiente ecuación química:
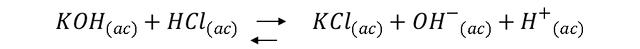
La fenolftaleína se tiñe de rosa cuando alcanza un pH de 8, esto ocurre cuando la base y el ácido han sido neutralizados, es decir, se ha alcanzado el punto final de la titulación, ya que ambos iones están en la misma cantidad, no hay variación de la concentración de estos iones, para lo cual el pH está determinado por el medio, en este caso H2O según la ecuación química:
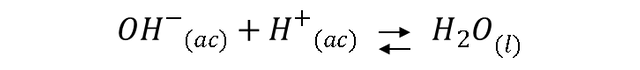
Se realizaron cálculos matemáticos para determinar la molaridad del HCl preparado y se obtuvo una molaridad de (0,0944 ± 0,0007) M. Para hacer esto, se usaron los volúmenes expresados en la Tabla 2.1 y se hicieron sus respectivas estadísticas
Experiencia 2.
Tabla 3 Valoración de un problema de muestra de KOH. Muestra # 7.
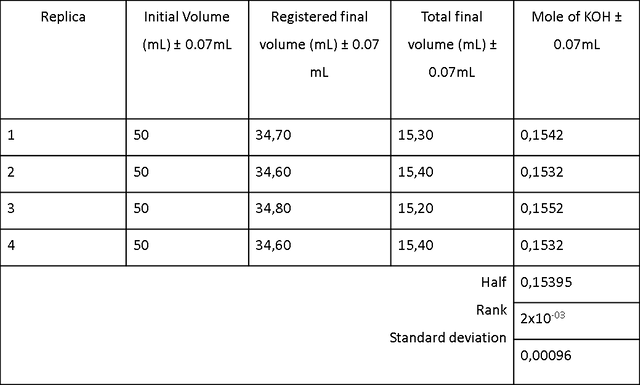
La Tabla 4 muestra los resultados de los volúmenes de KOH de la muestra n. ° 7 de concentración desconocida añadida para 4 valoraciones de 25 ml de una solución de HCl 0,09648M. Para calcular la concentración de KOH, se tomaron los volúmenes y de acuerdo con la ecuación:
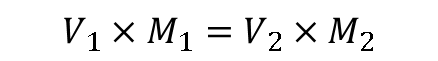
En los cálculos se usan como V1 = 25 ml y M1 = 0.09648M de HCl y como V2 cada uno de los valores de KOH obtenidos en la titulación, una molaridad de KOH de (0, 15395 ± 0.00096) M .
CONCLUSIONES.
•El punto de equivalencia en una titulación es el punto donde la especie alcanza la igualdad estequiométrica y no es un punto que se puede observar en presencia de un indicador de pH. El punto final es la culminación de la titulación que se puede ver por el cambio de color de la solución que se titula.
• El objetivo realizado en la práctica no se tuvo en cuenta ya que el valor del volumen del objetivo era muy pequeño y, por lo tanto, insignificante.
• La concentración de KOH de la muestra n. ° 7 es: (0.155395 ± 0.00096) M.
• La concentración de la solución de HCl preparada en la experiencia 1 es (0.0944 ± 0.0007) M.
• En el momento del titular, se deben usar volúmenes exactos ya que los cálculos de las concentraciones que se determinan dependerán de esto.
BIBLIOGRAFIA.
- Chang, Raymond (2010); Chemistry (10ª Edición), McGrawHill, Capítulo 5 (Titulaciones), Pp. 293-317.
- Fernández Alberto, García Francisco (2014) Manual de laboratorio de principios de Química (Vol2), Universidad Central de Venezuela, Facultad de Ciencias, páginas 42-47.
Trabajo realizado en los laboratorios de la Universidad Central de Venezuela.

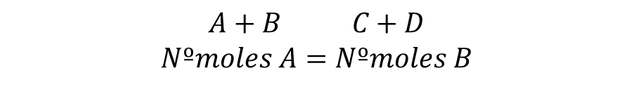
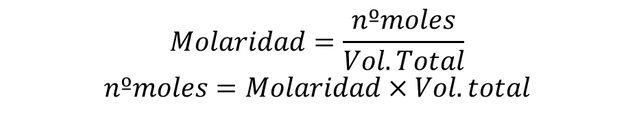
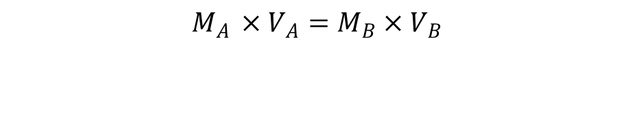
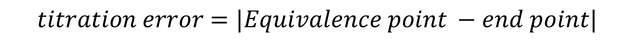









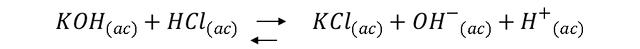
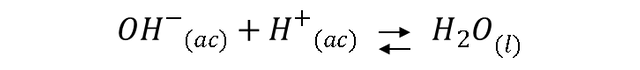

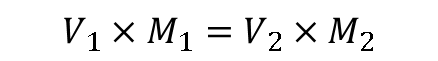
¡Felicitaciones tu publicación ha sido seleccionada para ser destacada por el Proyecto de Curación @Codebyte!
Si deseas contribuir y conocer sobre este proyecto puedes seguirlo y estar atento a sus publicaciones. Ingresando aquí podrás ver el reporte en donde tu publicación ha sido destacada.
Interesante y muy didáctico tu post @norihany sobre Titulaciones Ácido-Base. Comenzaré a seguirte, me es de interés la información que compartes. Saludos
Muchas gracias, que bueno que te agradara, un saludo.Hi @norihany!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV