ASPECTOS RELEVANTES SOBRE LAS NEUROHORMONAS INVOLUCRADAS EN LA REGULACIÓN DE LA METAMORFOSIS Y LA REPRODUCCIÓN DE LOS INSECTOS (ENSAYO ACADÉMICO)

INTRODUCCIÓN:
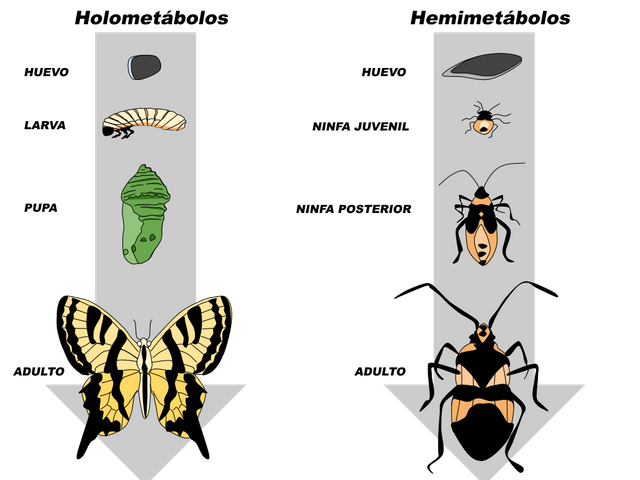
Los insectos poseen centros neurosecretores que de manera similar a los de los artrópodos, producen neurohormonas las cuales controlan aspectos fundamentales del animal, como el crecimiento, la diferenciación, el obscurecimiento de la cutícula, la eclosión y el balance hídrico. Algunas de estas funciones se realizan por acción directa de la hormona sobre el tejido blanco, mientras que otras se efectúan a través de acciones sobre glándulas endocrinas. El crecimiento y la diferenciación en los insectos están coordinados y regulados por hormonas. Los insectos se dividen en dos grandes grupos, los holometábolos y los hemimetábolos, de acuerdo a sus patrones de desarrollo. En los holometábolos, la metamorfosis es completa: las formas larvales y la pupa difieren entre sí y con respecto al imago. Un ejemplo estaría representado por la progresión desde oruga a crisálida y desde esta última a mariposa (Fig. 1). En el hemimetábolo (metamorfosis incompleta), la forma larval es similar a la del adulto, aunque de menor tamaño, ausencia de alas y genitales inmaduros. Ejemplos de insectos hemimetábolos son la cucaracha (Periplaneta americana) y el chipo (Rhodnius prolixus). Lo antes mencionado significa que mientras el crecimiento a través de la muda es un desarrollo continuo hacia las características del adulto en los hemimetábolos, en los holometábolos comprende una etapa de reposo aparente como pupa o crisálisa.
EL CONTROL DE LA MUDA:

En el control hormonal de la muda y la metamorfosis intervienen la hormona del “cerebro” o protoracicotrópica (PTTH), los ecdiesteroides y las hormonas juveniles que conforman una familia de sesquiterpenoides. Estudios efectuados en Lymantria dispar demostraron que para que esos procesos tuvieran lugar era indispensable la existencia de una hormona del “cerebro”, designada como protoracicotrópica (PTTH) por cuanto activa los procesos de síntesis y secreción de ecdiesteroides en las glándulas protorácicas (PG). La química de la PTTH ha sido investigada por muchos años, sin haberse obtenido éxito en la dilucidación de su estructura molecular aun cuando su naturaleza proteica está bien establecida. Su peso molecular oscila entre 4,4 y 30 kDa. Estudios efectuados en Bombyx mori indican la existencia de una forma única de PTTH de 4,4 kDa. En oposición a lo anterior, en Manduca sexta la PTTH aparentemente existe más de una forma molecular. Actualmente está ampliamente aceptado que la PTTH actúa sobre las PG antes de cada muda y durante la metamorfosis inicial. Sin embargo, varios reportes sobre factores propioceptivos y ambientales que afectan la muda sugieren la existencia de reguladores adicionales de la actividad de las PG. En efecto, existe creciente evidencia de que adicional al efecto trópico de la PTTH, el protocerebro posee también un efecto protoracicoestático que regula las concentraciones de ecdiesteroides en la hemolinfa. En ese contexto, se conoce la existencia de la bommo – miosupresina (BMS), que es un péptido relacionado con FMRF amida (FaRP) e identificado como factor protoraxicoestático en Bombyx mori. BMS suprime la esteroidogénesis en las PG, donde el receptor BMS (BMSR) está altamente expresado, siendo interesante que estos receptores responden a otros dos péptidos FaRP provenientes de otra especie de lepidópteros como es Manduca sexta. En este último caso, el efecto también es inhibitorio para Bombyx mori.
Tales resultados sugieren que otros péptidos FaRP endógenos en Bombyx mori también pueden actuar como factores protoracicoestáticos. También existen péptidos FaRP que regulan la esteroidogénesis a través de inervación directa sobre las PG en Bombyx mori. El gen correspondiente a la FMRF amida de Bombyx (Bommo-FMRF amida, BRFa) codifica para esos péptidos FaRP adicionales. Todos esos péptidos BRFa suprimen la esteroidogénesis en PG a través de la reducción de la producción de AMPc por la vía del receptor para la Bommo – miosupresina. BRFa es expresado predominantemente en las células neurosecretoras de los ganglios torácicos y las neuronas en el ganglio protorácico que inervan PG y suministran esos péptidos a la superficie de la glándula. Actualmente, se conoce que la PTTH es sintetizada por cuerpos neuronales (somas), situados en las regiones dorsolaterales del protocerebro y luego, transportada por vía axoplasmática a los cuerpos alados en donde se almacena. De allí es liberada a la hemolinfa cuando existen las condiciones apropiadas de estimulación. Por vía hemolinfática se distribuye por todo el cuerpo, actuando, por lo menos, sobre las glándulas protorácicas. Sus efectos a nivel celular son variados, conociéndose que eleva el potencial de membrana de las células protorácicas, por lo que afecta la permeabilidad de la membrana plasmática. Adicionalmente, induce la síntesis de ARN en glándulas protorácicas inactivas, siendo probable que esta acción sea mediada por el AMPc. No existe discusión en relación a que la secreción de la PTTH por el ganglio cerebral es la primera etapa reconocida en el complejo fisiológico que conduce a la síntesis de un exoesqueleto funcionalmente nuevo. De aquí se infiere que el comienzo de la muda en los insectos reside en los mecanismos que controlan la secreción de la PTTH. Ejemplos de estos mecanismos son variados, pudiéndose establecer la existencia de dos categorías, a saber, aquellos donde el estímulo retrasa la muda y aquellos que aceleran el proceso.
EL CONTROL FISIOLÓGICO DE LA SECRECIÓN DE LA PTTH EN HEMÍPTEROS:

En 1934 Wigglesworth había notado que las larvas de Rhodnius prolixus no mudaban mientras no ingirieran sangre, en tanto que siempre tenía lugar la muda cierto período característico de tiempo después de la ingesta. Una larva 4ª, por ejemplo, requiere 15 días luego de la ingesta para mudar (T = 24 ºC), mientras que una 5ª larva requeriría 28 días. Wigglesworth también observó que la muda podía ser prevenida si la larva era decapitada pocos días después de la ingesta de sangre, aunque los chipos decapitados sobrevivían varios meses. Efectuando decapitaciones en tiempos cuidadosamente controlados mostró que en cada larva existía un período crítico, antes del cual la cabeza era necesaria para la muda. Este período crítico finaliza a los 4 días después de la ingesta en la 4ª ninfa y a los 7 días en la 5ª ninfa. Wigglesworth también demostró que en la estimulación de la muda no estaban involucrados factores nutricionales sino que se trataba de un efecto de mera distinción mecánica. Ello le permitió concluir que el estiramiento del abdomen provocaba impulsos nerviosos al ganglio cerebral, causantes de la secreción de la hormona de la muda, aun cuando la hormona que se segrega en respuesta al estímulo nervioso es la PTTH. Aproximadamente 50 años después de la aparición de la hipótesis de Wigglesworth, fueron descritos por Anwyl el comportamiento y las propiedades de los receptores de estiramiento en el abdomen de Rhodnius prolixus. En los últimos 20 años Truman y sus colaboradores han revelado que la secreción de varias hormonas del desarrollo de Lepidóptera es controlada por relojes biológicos. En la larva de Manduca sexta, la secreción de la PTTH es regulada por un reloj fotosensible que puede activarse durante un lapso específico del ciclo luz – oscuridad. La muda está asociada al logro de un peso crítico en la última ninfa de Manduca sexta. Tal peso es de 5 g. Las larvas que se someten a inanición muestran un patrón de liberación de la PTTH que es errático y retrasado. Métodos de extracción y un adecuado bioensayo existen para la hormona juvenil (JH), aun cuando su aislamiento e identificación han sido intentados en pocos casos como los de Hyalophora cecropia y Manduca sexta. La hormona juvenil modula las reacciones tisulares a los ecdiesteroides y es producida en los cuerpos alados (Fig. 2). Se puede afirmar que mientras la hormona de la muda (el ecdiesteroide) es responsable por la inducción de la muda, la hormona juvenil controla la expresión cualitativa de la misma.

Fig. 2. Este diagrama ilustra el control neural y endocrino del crecimiento y la muda en un insecto holometábolo. Las células neurosecretoras del “cerebro” liberan la hormona protoracicotropica (PTTH) que estimula a la glándula protorácica a que libere los ecdiesteroides (ECD). La hormona juvenil (JH) se produce en el cuerpo alado y promueve la retención de los caracteres larvares. La diferenciación hacia el adulto la promueve el ecdiesteroide en ausencia de JH. Diagrama original propuesto por Stay, 2000. Elaborado por @josearmandor con Microsoft PowerPoint® 2010.
Cuando fue aislada por primera vez la JH, hace unos 50 años, y su estructura descrita varios años más tarde como un sesquiterpenoide (Fig. 3), se supuso que la base molecular para el control de la metamorfosis sería prontamente dilucidado. Lamentablemente, esa suposición fue errada. Aun cuando el circuito detallado de la actividad genética que involucra el desarrollo embrionario ha sido sustancialmente completado, por lo menos, en Drosophila, poco progreso se ha logrado en entender como la JH trabaja para controlar la metamorfosis. Una complicación emana del hecho de que en adición a su acción bloqueando la metamorfosis, la JH regula otros procesos. Ella puede servir simplemente como una hormona trófica, directa o indirectamente, activando genes específicos en ambos insectos inmaduros y adultos, así como en células cultivadas. Asimismo, la JH puede trabajar a nivel de la membrana del oocito, facilitando la captura de las proteínas de la yema. La JH controla un amplio conjunto de procesos en diversos insectos como la determinación de la casta, pigmentación, diapausa y producción de feromonas. Ningún receptor ha sido descubierto para esas funciones.
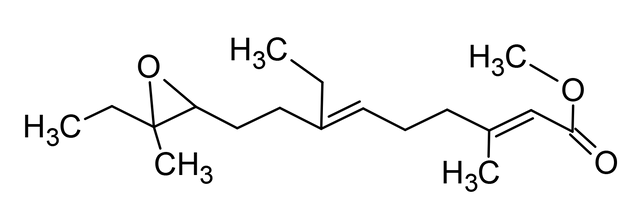
Fig. 3. Estructura de la hormona juvenil de Hyalophora cecropia (metil-10-epoxi-7-etil-3,11-dimetil-2,6tridecadioenoato), químicamente corresponde a un sesquiterpenoide. Elaborada por @josearmandor con Adobe® Photoshop® 6.
En la década del 50, Scharrer predijo que neurosecreciones del ganglio cerebral regulaban la actividad del cuerpo alado (Fig. 2), basada en la observación del cambio en la localización del material neurosecretor en el ganglio cerebral y el cambio en la actividad de la glándula después del daño a los nervios entre ese ganglio y el cuerpo alado. El aislamiento y caracterización de los reguladores neuropéptidos de la producción de JH por el cuerpo alado en la década del 80 confirmó la predicción de Scharrer. Ambas alatotropinas estimuladoras y alatoestatinas inhibidoras han sido aisladas del ganglio cerebral de insectos. Dos familias de alatoestatinas han sido aisladas de cucarachas y grillos. En la Fig. 4 se ejemplifica la manera como se induce la muda en Rhodnius prolixus. Las líneas interrumpidas indican el nivel de decapitación, en tanto que el punto negro en el extremo proximal de la cabeza representa el cuerpo alado y el número del estadío está indicado en el tórax representado por una letra. El adulto decapitado está acoplado a dos ninfas no. 5, totalmente decapitadas después del período crítico y con dos ninfas en el estadío no. 4, parcialmente decapitadas después del mencionado período. Las ninfas no. 5 proporcionan al imago ecdesteroides, mientras que las no. 4, al poseer su cuerpo alado suministran hormonas juveniles en adición al ecdiesteroide. Todas las ninfas mudan: Las no. 5 se transforman en supernumerarias (ninfa no. 6), las ninfas no. 4 pasan a no. 5, en tanto que el adulto regresa a un estadío similar al de una ninfa.
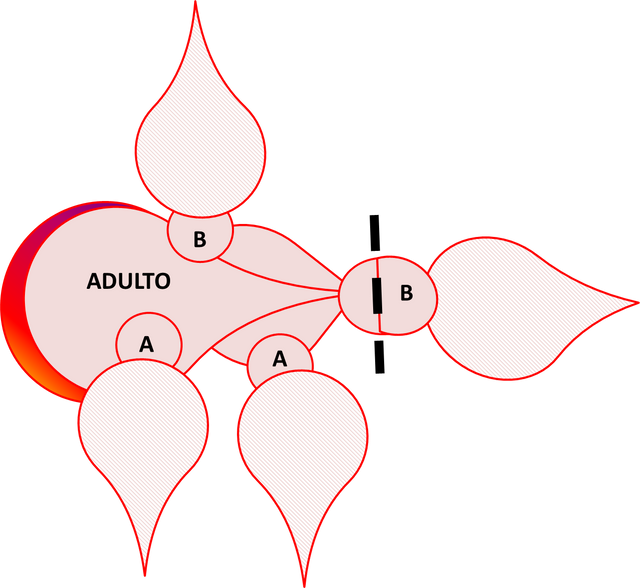
Fig. 4. Inducción de la muda en el adulto de Rhodnius prolixus. En esta figura, A representa el estadío 4, en tanto que B representa el estadío 5. Figura original propuesta por Morton, 2002. Elaborada por @josearmandor con Microsoft PowerPoint® 2010.
OTRAS SECRECIONES HORMONALES (NEUROSECRECIONES) EN LOS INSECTOS:
LA HORMONA DE LA ECLOSIÓN:
El neuropéptido hormona de la eclosión (EH) fue inicialmente identificado como un factor liberado hacia la hemolinfa que provoca el paso de pupa a imago, proceso denominado eclosión, constituyendo por ello la última écdisis. Sin embargo, la liberación de EH, péptido de 62 aminoácidos, tiene lugar después de cada écdisis en una amplia variedad de insectos. En el insecto Manduca sexta se ha revelado recientemente que el control de la écdisis es mucho más complejo de lo que originalmente se pensó. La iniciación de la écdisis y el comportamiento preparatorio de la pre-écdisis (premuda) involucra una retroalimentación positiva entre dos péptidos, el EH y un péptido no relacionado, como es la hormona disparadora de la muda (ETH). Al menos tres poblaciones de células son blanco para EH, las cuales muestran un incremento del GMPc estimulado por EH. Estas células blanco para EH son las siguientes: Dos pares de neuronas en cada ganglio de la cuerda nerviosa ventral que contienen el péptido cardioactivo de los crustáceos (CCAP), las células Inka de las glándulas epitraqueales y unas células no neuronales intrínsecas en los nervios transversales abdominales. En la cascada de señalización que resulta del incremento del GMPc estimulado por EH interviene una guanilil ciclasa soluble insensible al óxido nítrico.
EL PROCESO DE LA DIAPAUSA:
En muchos insectos los ciclos vitales incluyen un período de reposo a objeto de evitar condiciones adversas. Sin embargo, el mismo puede constituir una fase del ciclo vital que aparece regularmente bajo las condiciones más favorables. Ese período puede hacer su aparición en cualquier etapa del insecto: huevo, ninfa, pupa o adulto. La diapausa se caracteriza por un metabolismo muy disminuido, presencia de grandes reservas de lípidos, resistencia a la desecación y el frío. La resistencia a la desecación es una característica importante para los insectos estivantes en las regiones tropicales áridas, en tanto que la resistencia al frío permite al insecto soportar temperaturas de hasta -10 ºC, las cuales son generalmente letales para el invertebrado.

En los insectos con un crecimiento post-embrionario largo (1 o más años), la diapausa puede tener lugar a tiempos precisos independientemente de las condiciones ambientales, siendo conocida esta diapausa como obligatoria. Esta última está asociada a las especies que tienen una generación cada año. En las especies con dos o más generaciones por año, la diapausa ocurre solo en la generación que soporta la condición desfavorable. Ejemplo de este tipo de diapausa es la que se manifiesta en el insecto Pieris brassicae (mariposa blanca del repollo). Este insecto pone sus huevos al comienzo del verano, las larvas emergen de éstos, se desarrollan hasta pupa que sobrevive el invierno en diapausa, para luego convertirse en adulto durante la siguiente estación. Esta diapausa es llamada facultativa, puesto que depende para su aparición de condiciones ambientales favorables. La hormona de la diapausa es producida en Bombyx mori por el ganglio subesofágico, ocurriendo tal período durante la embriogénesis. La hormona de la diapausa (DH) constituye un péptido de 24 aminoácidos y exhibe una homología secuencial con PBAN (péptido activador de la biosíntesis de feromonas) / MRCH (hormona de mielinización y coloración roja). Las células glandulares del epitelio del proctodeo producen un péptido denominado proctodona que participa en la finalización de la diapausa al activar el complejo neurosecrector del “cerebro”.
HORMONAS CONTROLADORAS DE LA DIURESIS:
A causa de su pequeño tamaño y la razón grande área superficial: volumen, los insectos confrontan problemas formidables en relación al agua y al balance iónico. La pérdida de agua es minimizada a través de un número de mecanismos físicos y ambientales, aun cuando el mantenimiento homeostático del medio interno depende del control de la excreción. En el control de la diuresis están involucradas neurohormonas, siendo los mismos péptidos de bajo peso molecular que pueden estimular la pérdida de líquido (hormona diurética) o provocar la disminución de la mencionada pérdida (hormona antidiurética). El origen de esos neuropéptidos se encuentra en el cuerpo cardíaco. En general, se considera que los insectos tienen un sistema excretor compuesto de dos partes, donde la primera orina es formada por secreción de los túbulos de Malpighi, en tanto que el contenido de la excreta final es controlado a través de la reabsorción por el recto. La orina producida por los túbulos es isosmótica a la hemolinfa y contiene la mayoría de los solutos pequeños de ésta. La excreción líquida es conducida por transporte activo, principalmente K y algunas veces Na, a la luz del túbulo, seguidos pasivamente por el Cl. Por ello, el KCl es normalmente el soluto predominante en el líquido tubular, mientras que las concentraciones de otros solutos como azúcar y aminoácidos son bajas en relación a la hemolinfa. Los túbulos también son capaces de secretar activamente sustancias tóxicas como los glicósidos cardíacos, los alcaloides vegetales, el magnesio y el sulfato, los cuales de otra manera podrían difundir solo lentamente al lumen. La composición iónica de la orina, con sus concentraciones altas de K y bajas de Na, podrían alterar rápidamente y en forma deletérea la composición de la hemolinfa, sino fuese por la reabsorción selectiva del intestino. El volumen del líquido excretado está determinado por el control hormonal de la excreción tubular y la reabsorción rectal.
Bibliografía consultada:
• Gilbert, L.I.; Granger, N. A. & Roe, R.M. (2000). The juvenil hormones: historical facts and speculations on future research directios. Insect Biochem. Mol. Biol. 30: 617-644.
• Hartenstein, V. (2006). The neuroendocrine system of invertebrates: a developmental and evolutionary perspective. J. Endocrinol. 190: 555-570.
• Morton, D. & Simpson, P. J. (2002). Cellular signaling in eclosion hormone action. J. Insect Physiol. 48: 1-13.
• Stay, B. (2000). A review of the role of neurosecretion in the control of juvenil hormone synthesis: a tribute to Berta Scharrer. Insect Biochem. Mol. Biol. 30: 653-662.
DESCUBRE OTROS ARTÍCULOS INTERESANTES VISITANDO LA ETIQUETA #stem-espanol.



Congratulations! This post has been upvoted from the communal account, @minnowsupport, by josearmandor from the Minnow Support Project. It's a witness project run by aggroed, ausbitbank, teamsteem, theprophet0, someguy123, neoxian, followbtcnews, and netuoso. The goal is to help Steemit grow by supporting Minnows. Please find us at the Peace, Abundance, and Liberty Network (PALnet) Discord Channel. It's a completely public and open space to all members of the Steemit community who voluntarily choose to be there.
If you would like to delegate to the Minnow Support Project you can do so by clicking on the following links: 50SP, 100SP, 250SP, 500SP, 1000SP, 5000SP.
Be sure to leave at least 50SP undelegated on your account.
Hola. ciertamente conocía las fases de algunos artropodos como los aedes y triatominos pero desconocía por completo todo el mecanismo neurohormonal relacionado, excelente revisión. saludos.
Muchas gracias por tu comentario @joseangelvs, en efecto, los descubrimientos de la fisioentomología han sido sumamente enriquecedores para la ciencia, incluso, muchos modelos de insectos, como los Triatominos por ejemplo, han revelado mecanismos análogos en vertebrados, que hasta ahora eran desconocidos. Que bueno que esta publicación haya sido de tu agrado, saludos.
Debo felicitarte estimado amigo @josearmandor, en efecto no sólo interesante tu post visto desde del maravilloso mundo biológico, sino que además en lo académico, es una publicación bien esquematizada, condensada que le da méritos, para ser valorada de manera positiva por la plataforma. Saludos, sigamos creciendo.
Mil gracias apreciado @lupafilotaxia, comentarios positivos y constructivos como los suyos alientan a los miembros de la comunidad a seguir realizando manuscritos de calidad para ser compartidos en la plataforma, saludos cordiales.
Hermano @josearmador, excelente post solamente con la diagramación se nota el esfuerzo implementado para su publicación, y puedo decir que desde hoy conozco las neurohormonas que influyen en la reproducción de los insectos, aspecto de alta relevancia en el sector agropecuario. Nos seguimos leyendo hermano !
Muchas gracias por el comentario @amestyj, ciertamente es así, la entomología en cualquiera de sus subáreas es un complemento necesario en el desarrollo de las ciencias del agro, espero que la publicación haya sido de utilidad, saludos.