Biología y Química de la mano. Parte II Reacciones químicas: Práctica de laboratorio para las Evidencias de cambio químico
Hola a todos

Introducción
Las prácticas de laboratorio, son estrategias de enseñanza de carácter empírico-inductivo que indiscutiblemente promueven las destrezas cognitivas, el deseo por investigar más sobre los contenidos escolares, corroborar lo discutido durante las clases teóricas, contrastan las diversas opiniones dentro del alumnado sobre los fenómenos naturales y demás. Por consiguiente, aplicar estas actividades resaltando no solo las aplicaciones que tiene dentro del mundo científico sino la dentro de la vida cotidiana, contribuye a una mejor comprensión de los procesos por lo tanto conlleva un aprendizaje eficaz.
En este orden ideas, el siguiente post para esta segunda entrega de reacciones químicas, abarcará un esbozo teórico y el procedimiento de laboratorio para las evidencias de las reacciones químicas. Recordando que este tipo de actividades con los materiales adecuados pueden ser compartidos con los estudiantes durante las clases, además de armonizar los fenómenos estudiados en el campo de la biología con la química.

Breve explicación teórica
Como fue explicado en el anterior post, las reacciones químicas ocurren cuando los enlaces químicos de los átomos sufren una ruptura, transformación o formación. En dicha reacción, se destacan los que participan en la reacción conocidos como reactivos y de ello se genera un resultado, es decir se obtiene algo, ese algo al final de la reacción es llamado producto. Por ejemplo, tenemos el caso del peróxido de hidrogeno o agua oxigenada, como se pude apreciar en la imagen:
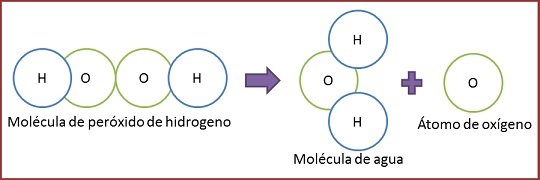
El peróxido de hidrogeno, actúa como un reactivo, para este caso particular ocurre un tipo de reacción química llamada descomposición en la cual la molécula se descompone en dos estructuras, formando los productos oxígeno y agua. Además, el agua oxigenada tiene muchas aplicaciones una de ellas es la desinfección, puesto que produce estructuras químicas que reaccionan con una diversidad de compuestos orgánicos, ejemplo de ello, es cuando la catalasa que es un enzima que forma los tejidos, está en presencia del peróxido de hidrogeno, reaccionan llegando a formar oxígeno, favoreciendo la no infección debido que complica el crecimiento germinal de esporas de tipo de vida anaeróbicas.
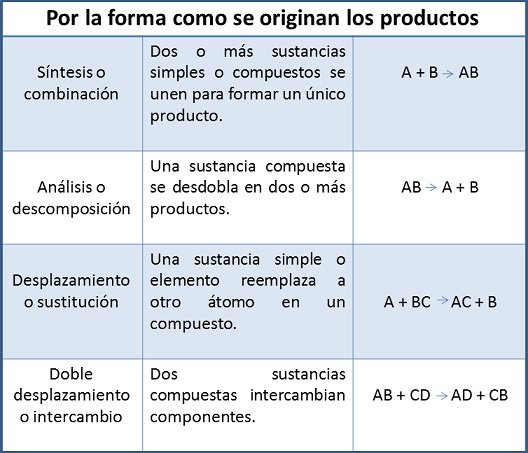
Bajo este contexto, los cambios químicos de las sustancias experimentan transformaciones no solo en su apariencia, hay modificaciones profundas en su composición química y en sus propiedades características., lo que permite concluir que se han formado nuevas sustancias o productos a partir de las sustancias de partida o reactivos. A la par, las reacciones químicas presentan unas clasificaciones establecidas por determinados criterios. En el anterior post, fueron explicados: síntesis o combinación, análisis o descomposición, desplazamiento o sustitución y doble desplazamiento o intercambio.
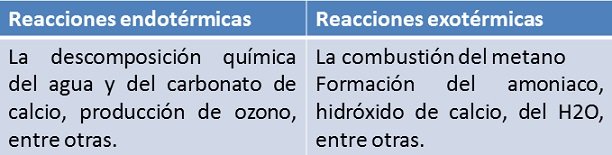
También tenemos las reacciones endotérmicas, siendo aquellas que necesitan absorber energía o absorber suficiente calor del medio externo para que pueda reaccionar. Dentro de los ejemplos que podemos encontrar, tenemos la producción del ozono en la atmosfera, la reacción se lleva a cabo en las capas de la atmósfera. Una característica presencial en las reacciones es que pueden llegar a enfriar. En el caso de la fotosíntesis de las plantas, con la llegada de los fotones para desencadenar reacciones químicas, de igual manera, para cuando se generan tormentas, entre otras.
Por otro lado, tenemos las reacciones exotérmicas, que son lo contrario, estas reacciones liberan la energía o calo cuando la reacción ocurre. Ambas tipos de reacciones a veces son clasificadas como reacciones térmicas. A diferencia de las otras, estas pueden calentar. Dentro del conjunto de ejemplos, tenemos el caso de la respiración de los organismos, en el proceso de la digestión, y muchos más que después vamos a tratar.
Como bien fue señalado, los cambios o fenómenos químicas implican la ruptura de enlaces en los reactivos, reacomodo de átomos y formación de nuevas enlaces en los productos, proceso que no pueden ser percibidos por el ojo humano. Sin embargo, existen una serie de evidencias que permiten decir si ha ocurrido un cambio químico. Estas evidencias son:
- Producción de gases: Se liberan O2, H2, Cl2, H2O.
- Producción de efervescencia: se libera CO2.
- Formación de un precipitado: material sólido que se deposita.
- Cambios de color y olor: descomposición de carne.
- Emisión de luz y/o calor: la combustión de gas doméstico.
- Cambios de temperatura: al encender una vela aumenta la temperatura a su alrededor.
Materiales
- Tubos de ensayo.
- Cilindros graduados.
- Gotero.
- Globo.
- Pinzas.
- Embudo.
- Botella de refresco.
- Azúcar.
- Hidróxido de potasio.
- Vinagre.
- Bicarbonato de sodio.
- Ácido clorhídrico.
Procedimiento de Laboratorio
1.- Desprendimiento de gas
- Vierte en una botella de refresco 20ml de vinagre.
- En un globo introduce una cucharadita de bicarbonato de sodio.
- Sujeta el globo a la boca de la botella cuidando que el bicarbonato de sodio no caiga sobre el vinagre.
- Levante el globo y deja caer el bicarbonato sobre el vinagre.

2.- Cambio de color
- En un recipiente de vidrio coloca 10gramos de azúcar.
- Con cuidado y lentamente añade 5ml de ácido sulfúrico concentrado.

3.- Formación de precipitado
- En un tubo de ensayo vierte 10ml de leche.
- Añade unas gotas de vinagre.
- Deja reposar el tubo de ensayo con su contenido.

4.- Cambio de temperatura
- En un vaso de precipitado colocar 1 gramo de hidróxido de potasio.
- Agrega con cuidado 3ml de ácido clorhídrico.
- Toca las paredes del recipiente.

5.- Cambio de color
- Vierte 20ml de refresco en un tubo de ensayo.
- Agrega 5ml de cloro comercial.

6.- Cambio de olor
- Vierte en un tubo de ensayo 4ml de etanol y con cuidado 4ml de ácido acético.
- Con un gotero añade 10 gotas de ácido sulfúrico concentrado.
- Con precaución percibe el olor en la boca del tubo.

7.- Traducción de efervescencia
- Deposita una pequeña cantidad de carbonato de sodio en un tubo de ensayo.
- Vierte 1ml de ácido clorhídrico lentamente y por las paredes internas del tubo de ensayo sobre el carbonato de sodio.
Discusión
- Bicarbonato de sodio + vinagre: desprendimiento de un gas. Carbonato de sodio + ácido clorhídrico: efervescencia. Los carbonatos y bicarbonatos al reaccionar con ácidos desprenden dióxido de carbono gaseoso que se observa como efervescencia y que permite inflar un globo de goma.
- Azúcar y ácido sulfúrico concentrado: cambio de color y olor. El ácido sulfúrico concentrado es un poderoso agente deshidratante, no solo elimina moléculas de agua de materiales que la contienen, también puede eliminar hidrogeno y oxigeno de compuestos que contienen esos elementos en cantidades similares a las que se presentan en la molécula de agua. El papel, la madera formados principalmente por celulosa y azúcar se carbonizan al entrar en contacto con el ácido sulfúrico concentrado, formándose carbón y agua.

- Leche + vinagre: formación de un precipitado. La formación de un precipitado irreversible, llamada desnaturalización, es causada por adición de calor, la variación del pH por adición de ácidos o de bases o por otros agentes. La desnaturalización origina cambios fundamentales en la estructura de la proteína y provoca la destrucción de la actividad fisiológica.
- Hidróxido de potasio + ácido clorhídrico: variación de la temperatura. La reacción entre un ácido (aporta iones H+) y una base o hidroxilo (aporta iones OH-) para formar moléculas de agua y una sal recibe el nombre de neutralización. Es una reacción exotérmica en la cual se libera calor a medida que se van formando los productos de la reacción.
- Refresco + cloro: cambio de color, decoloración. El cloro comercial es una solución acuosa de hipoclorito de sodio preparada al 5,25%. El efecto decolorante del cloro proviene de la acción del hipoclorito de sodio que actúa como agente oxidante, tomando electrones de la sustancia que desmancha o blanquea formando iones cloruros e hidróxidos.
- Las reacciones de efervescencia, las podemos encontrar en la vida cotidiana en los refrescos, como las bebidas carbonatas, es decir gaseosa, soda y demás.
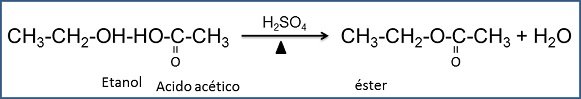
- Etanol + ácido acético + ácido sulfúrico. La reacción entre un ácido y un alcohol para formar un éster y agua recibe el nombre de esterificación. En ésta reacción el hidrógeno ácido ha sido reemplazado por un radical orgánico. Los ésteres determinan el olor característico de las flores y frutas y se emplean en la fabricación en la fabricación de sabores artificiales o sintéticos.
Nota final
Todas las evidencias de las reacciones químicas, permiten a los estudiantes percibir con los sentidos determinados fenómenos naturales y que pueden incurrir en su vida cotidiana. Además, llevar la rutina de procedimiento de laboratorios beneficia el comportamiento, la observación experimental, motivación para realizar actividades empíricas, entre otros aspectos prácticos y teóricos.
Referencia bibliográfica y fuente de las imágenes
- Aportes para la enseñanza para el nivel medio. Consultado 2018
- Trujillo. Soluciones acuosas: teoría y aplicaciones. Módulo de apoyo académico en Química
- Cada una de las imágenes son propias, editadas en power point y Paint.
- KHANACADEMY. Tipos de Reacciones Quimicas. Consultado: 2018
- Portal educativo. Unidad de Reacciones Quimicas. UNAM. Mexico. Consultado: 2018
Excelente planteamiento, experimentar y asociar los fenómenos a raíz de las reacciones químicas motivan a empaparse más con ellas, gracias por compartir.
PD: ¿Has hecho lo de byteball? Es una oportunidad para ganar dólares tras solo descargar y seguir unos pasos, sino lo has hecho, acabo de hacer un tutorial que puede ayudarte :D
Hola, gracias por comentar.
Felicitaciones @hogarcosmico, tu manuscrito esta muy didáctico, tal como lo indicas, para las unidades curriculares con contenido de laboratorio, la mejores estrategias de enseñanza, siempre las encontraremos en la inducciones prácticas. Saludos
Muchas gracias por tu aporte. Concuerdo que esta es una de las muchas estrategias de enseñanza que pueden ser aprovechadas. Feliz día.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Muchas gracias por el apoyo.
Hi @hogarcosmico!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Gracias por el continuo apoyo.