BIOCATALIZADORES. LA NUEVA PIEDRA FILOSOFAL DE LA INDUSTRIA.
Saludos estimados amigos, en esta oportunidad quise complementar el tema de mi publicación anterior, ya que la utilización de enzimas es un área muy interesante y que promete un gran futuro debido al poder catalítico que entrañan.
En los oscuros comienzos de la química, cuando aún nuestros primeros científicos eran solo alquimistas, no solamente se sabía de la existencia de ciertos materiales que podían avivar la transformación de algunas sustancias, lo que los llevo a buscar arduamente la llamada piedra filosofal, sino que; sin saberlo, durante siglos ya el hombre venía utilizando microorganismos para inducir ciertas transformaciones en los alimentos para su beneficio. Entonces, antes de que pudieran conocerse las bases de los procesos biocatalizados, la capacidad catalítica de las enzimas producidas por microorganismos como la levadura o las bacterias lácticas ya era empleada en la elaboración de vinos, pan, quesos, cervezas y vinagre.
Así, la catálisis dio sus primeros pasos; pero tendríamos que esperar hasta que el sueco Berzelius le acuñara este término, en 1.836, al proceso de producir alteraciones en la velocidad de reacción; y aunque luego en 1.867 Wilhelm Küne postulara el término enzima por primera vez, el conocimiento más profundo de su cinética y estructura no fue alcanzado sino hasta los años 1.960. En la actualidad son numerosos los procesos biotecnologícos que se llevan a cabo mediante la utilización de microorganismos o de sus enzimas aisladas, convirtiendo este campo en uno de los más grandes por sus perspectivas de futuro.
El termino biocatálisis hace referencia a la utilización de células o sus enzimas aisladas para catalizar reacciones en la síntesis de productos de interés. Las enzimas reciben su nombre en función de su actividad específica, así por ejemplo la ureasa cataliza la hidrólisis de la urea, las amilasas son enzimas que catalizan la descomposición del almidón en azúcar. La molécula sobre la que actúa la enzima se denomina sustrato. El mecanismo más simple para explicar la catálisis enzimática es el propuesto por Michaelis-Menten, mostrado en la siguiente figura.
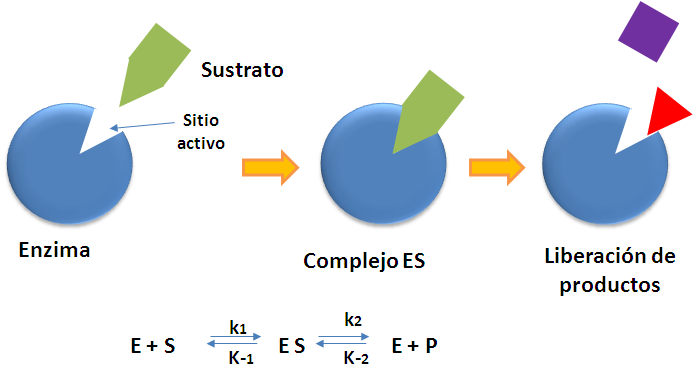
Figura 1. Mecanismo propuesto para la catálisis enzimática. Fuente: elaboración propia.
Donde E es la enzima libre, la cual se enlaza al sustrato S, para formar el complejo enzima sustrato ES, que se separa nuevamente en la enzima pero transforma el sustrato en el producto P.
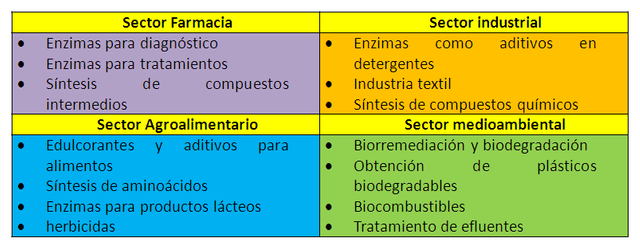
En los últimos años la utilización de enzimas ha demostrado ser eficaz en síntesis de diversos productos para la industria química, farmacéutica, de alimentos, biocombustibles, textil y detergentes; e incluso se han encontrado aplicaciones ambientales como en la recuperación de suelos contaminados y el tratamiento de efluentes. Algunas de sus aplicaciones se indican en el siguiente cuadro.
Pero el escalado a nivel industrial de cualquier proceso biocatalizado requiere de cumplir con una serie de etapas importantes como: 1) la selección de la enzima apropiada para el sistema a emplear, 2) su aislamiento y purificación, 3) determinación de las condiciones optimas para la reacción catalizada y 4) su inmovilización a fin de darle mayor estabilidad a la enzima.
PRODUCCIÓN INDUSTRIAL DE ENZIMAS
Hoy día los microorganismos son la principal fuente de enzimas para su uso industrial, principalmente debido a sus ventajas en comparación con las de origen animal. Principalmente existen diversos microorganismos cuya producción de enzimas es extracelular y se pueden hacer crecer in vitro, lo que facilita su purificación; en contraste con las de origen animal que resulta más compleja, ya que requieren de etapa previas como el aislamiento del tejido y su homogeneización, además de que las enzimas de origen microbiano no requieren grandes superficies, tienen gran velocidad de crecimiento y su rendimiento es predecible.
Los procesos de fermentación son los más empleados para la producción de enzimas, pudiendo ser estos procesos de superficies o en bioreactores, en los que se pueden emplear sustratos económicos y disponibles. En muchos procesos se emplean extractos de enzimas parcialmente purificados, pero cuando se trata de enzimas para uso terapéutico se requiere un alto grado de pureza; por lo que los métodos de purificación varían a escala industrial desde los métodos de centrifugación (para obtener un extracto libre de sedimentos), la ultrafiltración (para enriquecer o concentrar el extracto). En cuanto a su comercialización, las enzimas purificadas pueden presentarse en diferentes formas: liofilizadas, disueltas en un estabilizante o mezcladas con aditivos.
INMOVILIZACIÓN DE ENZIMAS
A pesar de las ya reconocidas ventajas que presentan las enzimas frente a los catalizadores químicos convencionales, su uso a nivel industrial no se ha generalizado debido a dos importantes condiciones que es muy importante tomar en cuenta: su limitada estabilidad, lo que conduce a una pérdida de actividad por desnaturalización de la enzima; y la dificultad para separarlas del medio de reacción y de los productos. Con la inmovilización de las enzimas se logra superar estos inconvenientes permitiendo que muchos procesos biocatalizados sean rentables.
La inmovilización consiste en la ubicación o confinamiento de las enzimas sobre un determinado material insoluble, para dar una forma en la que se puedan conservar las propiedades de la enzima y se pueda recuperar para ser reutilizada. En general, los métodos para la inmovilización de enzimas se pueden agrupar en dos categorías, la unión química, que consiste en la unión covalente o por interacciones iónicas sobre soportes que brinden estabilidad y resistencia mecánica; y la retención física, la cual consiste en el atrapamiento de las enzimas en las cavidades de una matriz sólida porosa.
Métodos de unión química
• Adsorción: es el método más común y económico, consiste la unión de la enzima al soporte se obtiene por medio de interacciones reversibles como fuerzas de Van der Waals y puentes de hidrógeno.
• Intercambio iónico: consiste en la unión de las enzimas por medio de interacciones iónicas a un soporte sólido que contiene compuestos cambiadores de iones. Lo que le confiere mayor fuerza de unión en comparación con la adsorción.
Métodos por retención física
• Atrapado: en este método se deja libre a la enzima en solución, pero su movimiento se restringe a una estructura determinada, como en un gel, de tal manera que se produzca la liberación de la proteína sin permitir que ingrese el sustrato a la estructura.
• Encapsulación: consiste en retener a la enzima dentro de una estructura esférica compuesta de una membrana semipermeable cuyos diámetros oscilan entre 10 y 100 μm, en tal sentido que las moléculas de sustrato y productos puedan difundirse libremente a través de la membrana.
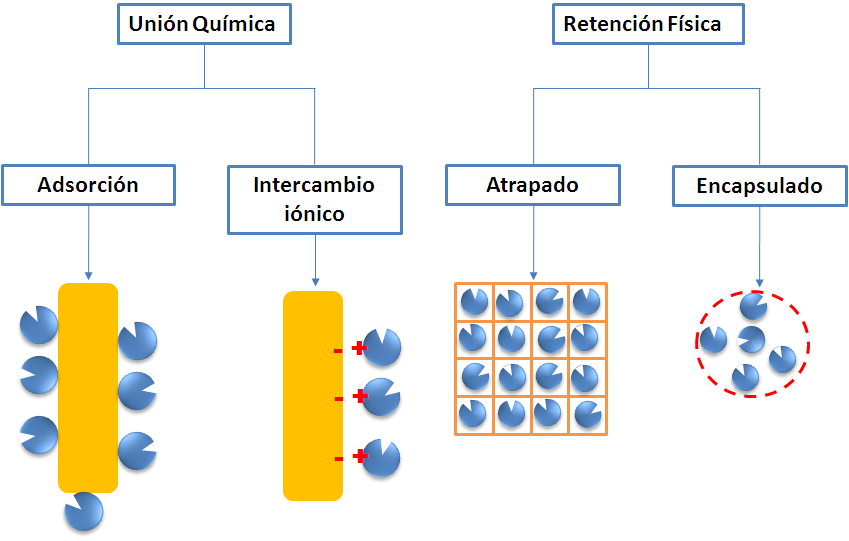
Figura 2. Métodos de inmovilización de enzimas. Fuente: elaboración propia.
Soportes para la inmovilización
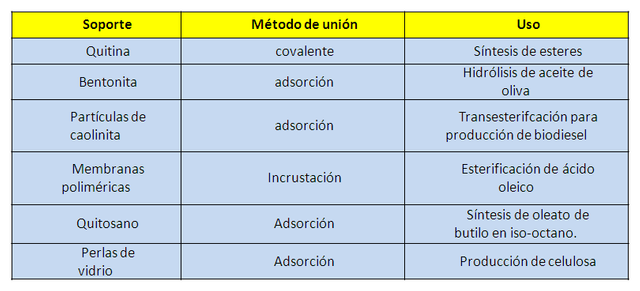
Existe una amplia variedad de soportes que tienen propiedades adecuadas para inmovilizar una enzima, en los que se pueden emplear compuestos naturales o sintéticos, de diferentes tamaños, formas y porosidad. Lo importante es que deben presentar características como: resistencia térmica y mecánica, alta afinidad por las proteínas, durabilidad química, capacidad de regeneración y económico. Algunos sistemas empleados para la utilización de lipasas inmovilizadas se muestran en la siguiente tabla.
ALGUNAS APLICACIONES INDUSTRIALES DE LAS ENZIMAS
En la industria alimenticia se encontró el primer nicho de aplicación de las enzimas. Estas son utilizadas para mejorar la fabricación, alguna característica o la calidad de algunos alimentos. Un ejemplo es la producción de jarabes ricos en glucosa por hidrólisis enzimática del almidón de maíz, estos jarabes se emplean en la preparación de bebidas y dulces. Otra aplicación es la obtención de leche sin lactosa; el pan es otro buen ejemplo, tradicionalmente en la elaboración del pan se basa en la presencia de enzimas en la mezcla de harina y agua, hoy en día las harinas se complementan con amilasas, proteasas y lipasas, que mejoran su sabor, calidad y textura de la corteza.
Si bien las enzimas han tenido éxito en la industria alimenticia, estos biocatalizadores han calado de manera importante en la industria química y farmacéutica. Por ejemplo la industria Bayer reporto el uso de la enzima penicilino G acilasa inmovilizada para la producción de precursores de penicilinas semisinteticas: Aunque estos productos son los principales obtenidos por esta vía, las enzimas también son empleadas para producir aminoacidos y esteroides.
En la industria textil también han conseguido interesantes aplicaciones, por ejemplo el lavado a piedra de los jeans, que se consigue frotando la prenda con un elemento abrasivo, también se ha logrado mediante el uso de diferentes celulasas microbianas. Si hablamos de los biocombustibles, la producción de bioetanol procede por la fermentación de la glucosa obtenida por medio de la hidrólisis enzimática del almidón de maíz, catalizada por enzimas como las amilasas y las glucoamilasas.
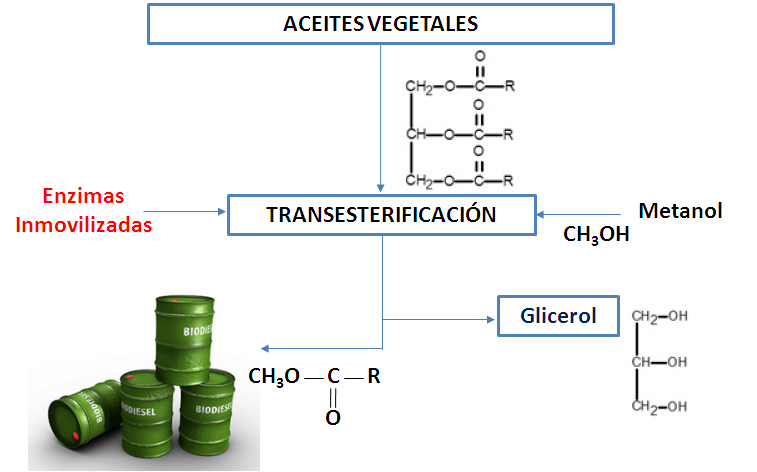
Figura 3. Producción de biodiesel por vía de la catálisis enzimática. Fuente: elaboración propia.
Indiscutiblemente la biocatálisis ha tenido un gran auge, en gran parte gracias a los avances que se han logrado en campos como la bioquímica y la microbiología, con lo que se han podido obtener y aislar enzimas en mayor cantidad y pureza, abaratando sus costos de producción. Y de la mano de la ingeniería genética el futuro ya se encuentra cerca, ya muchas empresas y laboratorios trabajan en la mutagénesis y la evolución dirigida de las enzimas, lo que ha permitido obtener nuevos catalizadores con mayor estabilidad y actividad en comparación con las enzimas nativas. Otros, como en mi caso, estamos trabajando en la obtención de enzimas y su inmovilización a partir de sustratos y soportes no convencionales, y así, seguir ampliando el campo de los biocatalizadores, como alternativa a la síntesis química tradicional.
Espero que les haya gustado la publicación y les brinde información útil. Saludos amigos, hasta una próxima entrega.

REFERENCIAS
Evidenzima, (2010). ENZIMAS, Disponible en http://evidenzima.blogspot.com/
Fuentes, S.; Díaz, G. Catalizadores. Disponible en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/059/htm/cataliza.htm
Gracia-Arechiga, C., liana, A., Arechiga-Carvajal, E., Segura, E. (2016). Producción de lipasa a través de la fermentación por adhesión a la superficie. ICIDCA, vol. 50, nº1, pp34-38.
Levine, I. (2004). Fisicoquímica. Quinta edición, McGraw-Hill. España.
Ramos, M. (2012). Inmovilización de dos lipasas para su aplicación en el pretratamiento de aguas residuales de la industria láctea. Universidad Nacional de Colombia, Colombia.
Biodiesel en barriles verdes fuente: Mitra Sahara, licencia CC0
Excelente trabajo Emilio Ojalá reconozcan tu destacada investigación.
Muchas gracias por tus palabras Breili, y por tomarte el tiempo de pasarte a leer el artículo, mis saludos!
¡Felicitaciones tu publicación ha sido seleccionada para recibir el Upvote y Resteem del Proyecto de Curación @Codebyte!
Si deseas apoyarnos y saber mas sobre este proyecto puedes seguirlo y estar atento a sus publicaciones. Ingresando aquí podrás ver el reporte en donde tu publicación ha sido destacada.
Super interesante articula, me hubiera gustado leerlo anteayer antes de mi parcial de enzimas jajaja.
Muchas gracias @briggitkatan. Oye que lastima no lo pude publicar antes jajaja, mis saludos y gracias por pasar a leer.