Aplicación de la transformada de Laplace en la resolución de ecuaciones cinéticas
Saludos estimados amigos de steemit .
Hace un tiempo leí el artículo del compañero @lorenzor sobre el Análisis de una red eléctrica en el dominio de la frecuencia compleja a partir de la transformada de Laplace, y le comentaba sobre la gran utilidad de esta herramienta para resolver también problemas de química. Pues, si bien este método de cálculo nos permite resolver problemas como el presentado de circuitos eléctricos por su aplicabilidad en el análisis de sistemas dinámicos, es poco lo que encontramos referido a la resolución de problemas en química.
Como sabemos, una reacción química es un proceso mediante el cual unas especies químicas (compuestos o elementos) interactúan para formar nuevas especies, lo que implica que a medida que transcurre el tiempo la concentración de las especies denominadas reactivos se va agotando mientras que la concentración de las especies formadas (los productos) se va incrementando, por lo que resulta necesario el uso de ecuaciones diferenciales respecto al tiempo para poder representar matemáticamente el sistema reaccionante.
Con la cinética química abordamos el estudio de la velocidad con la cual transcurre una reacción química, y dado que un sistema reactivo no se encuentra en equilibrio, constituyen modelos de sistemas variables con el tiempo, cuyo comportamiento puede representarse de manera aproximada mediante el uso de ecuaciones diferenciales lineales, en las cuales, la transformada de Laplace facilita su estudio.
Composición de imagenes de elaboración propia.
Con esta publicación quiero complementar el análisis a la resolución de problemas de cinética química utilizando esta poderosa herramienta de cálculo.
Fundamentos teóricos
Transformada de Laplace
No siempre es directo resolver ecuaciones diferenciales, pero nos podemos vales de operaciones de cálculo que pueden conducir a una solución que satisface las condiciones iníciales dadas. Los procedimientos para realizar estas operaciones se dan mediante las llamadas transformadas integral:
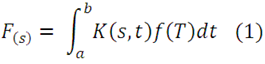
Donde F(s) es la transformada de f(T). La transformada F(s) de una función sujeta a la transformada de Laplace se define mediante la expresión:
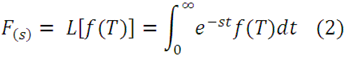
Mediante la cual ambos factores dependen del tiempo.
Velocidad de reacción
En el contexto de la cinética química, con el término velocidad de reacción se denota al cambio en la concentración de los reactivos con respecto al tiempo por unidad de volumen. Consideremos la siguiente reacción:
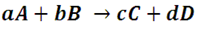
Donde a, b, c y d son los coeficientes estequiométricos de las especies químicas A, B, C y D. La velocidad a la que los reactivos se consumen es proporcional a la relación entre sus coeficientes estequiométricos, matemáticamente hablando se expresa de la siguiente forma:
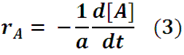
En términos generales la velocidad de reacción (r) se puede estimar en función de cualquiera de las especies químicas que intervienen en la reacción, pudiéndose expresar de forma general como:
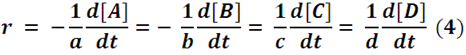
Donde: r es la velocidad de la reacción, [A], [B], [C] y [D] es la concentración de las especies químicas y t es el tiempo. Dado que A y B se consumen, es decir, su concentración final es menor que la inicial, el valor de d[A]/dt es negativo, por lo que se agrega el signo (-) delante de la expresión para la ecuación (4) siempre sea una función positiva.
Ecuación cinética
Para muchas reacciones se ha determinado experimentalmente que la velocidad de reacción en un determinado instante está relacionada con la concentración de las especies que participan en la misma mediante una expresión con la forma
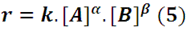
En la cual, k es una constante de proporcionalidad denominada constante cinética o de velocidad, mientras que α y β se conocen como ordenes parciales, y a la suma de ambos (α+β = n) se le da el nombre de orden total u orden de la reacción. Esto nos permite clasificar las reacciones según el valor de n en reacciones de orden cero, de primer orden, de segundo orden y así en general.
Integración de las ecuaciones cinéticas (leyes de velocidad)
Cuando realizamos experimentos para determinar la cinética de una reacción, por lo general la información que levantamos tiene que ver con la concentración de los reactivos en función del tiempo; entonces, para obtener una expresión que relacione las concentraciones y el tiempo debemos integrar las ecuaciones cinéticas.
Así por ejemplo, si tenemos una reacción simple, que transcurre a temperatura constante, de primer orden del tipo
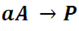
cuya ecuación cinética tiene la forma:
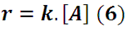
A partir de la expresión (3) y (6) se obtiene:
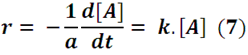
Para dar solución a esta ecuación diferencial basta con reagrupar los términos para proceder a integrar.
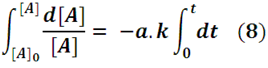
Lo cual conduce a la expresión
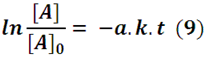
Que también podemos expresar de la forma
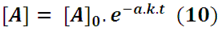
La expresión (10) nos sugiere que la concentración de A decrece de forma exponencial con respecto al tiempo para una reacción irreversible de primer orden.
Entonces, ¿Cuando aplicaremos la transformada de Laplace?
Bien, en los casos de reacciones simples, es decir, que proceden mediante una etapa directa e irreversible, cuyas ecuaciones cinéticas se ajustan a ecuaciones como (6), donde el orden es un entero, conducen a ecuaciones diferenciales fáciles de resolver.
Pero no todas las reacciones se ajustan a esta forma, veamos que ocurre en el caso de las reacciones consecutivas. Aquellas que tienen una forma general como la siguiente:
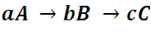
En este caso, el compuesto A reacciona para convertirse en B, y luego este reacciona para formar al compuesto C. En esta situación el proceso completo se describe mediante dos etapas que ocurren de forma consecutiva:
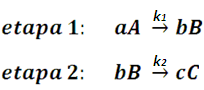
Vamos a suponer que ambas reacciones son de primer orden para no complicar más el asunto por ahora, y que k1 y k2 son las constantes de velocidad de cada reacción. Así, la ecuación de velocidad para el reactivo A nos quedaría expresada a partir de la ecuación (7) como:
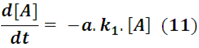
En la que podemos agrupar el producto del coeficiente estequiométrico y la constante de velocidad en una sola constante definida como ka, quedando expresada del siguiente modo:
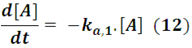
Pero para B la situación es diferente, ya que en un primer instante esta especie es un producto de la reacción en la primera etapa, siendo la velocidad con la que se produce:
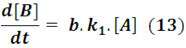
Y en otro instante, luego de iniciada la reacción, esta especie también toma el papel de reactivo para formar al compuesto C, siendo la velocidad a la que se consume igual a:
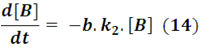
Agrupando las constantes y sumando las ecuaciones, la velocidad neta para el compuesto B vendría dada por:
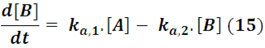
El caso del compuesto C es similar que el de A, esta especie solo se comporta como un producto, por lo que la velocidad a la cual se forma se puede expresar como:
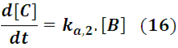
Entonces, como podemos observar, nos queda en este caso un sistema compuesto por las ecuaciones (12), (15) y (16) para describir el sistema reactivo. Pero, como podrán darse cuenta tenemos requerimientos matemáticos más complejos a los obtenidos en reacciones que constan de una sola etapa, debido a que tenemos más variables, [A], [B], [C] y el tiempo. Por lo que la aplicación de la transformada de Laplace resulta muy conveniente, dado que este método permite convertir ecuaciones diferenciales en ecuaciones algebraicas lineales, simplificando el procedimiento de cálculo.
¿Cómo aplicar el método?
Si deseamos aplicar la transformada de Laplace al sistema propuesto partimos por fijar las condiciones iníciales, es decir, en el instante de tiempo cero. Al inicio, suponemos que solo se introduce el compuesto A en el sistema, entonces en t=0, la concentración inicial de A es [A]0, la de B = 0 y la de C = 0, lo que nos conduce a expresar el siguiente sistema de ecuaciones algebraicas:
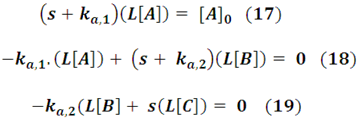
Este sistema lo podemos expresar de forma matricial de acuerdo a la siguiente forma:
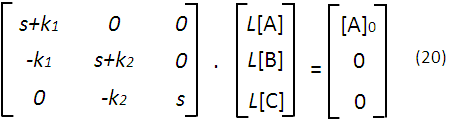
Con (20) se tiene una matriz que podemos resolver, por ejemplo, con el método de los determinantes, obteniendo las siguientes expresiones:
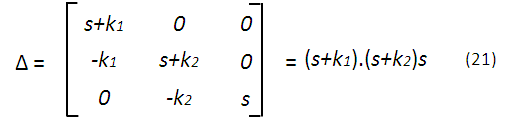
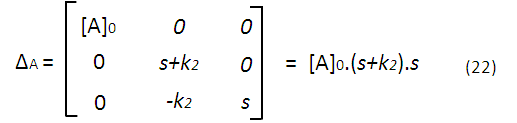
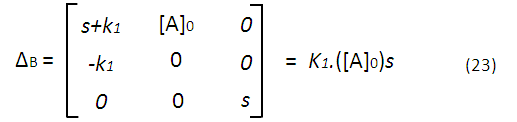
Lo que nos permite obtener expresiones para la concentración de cada especie química en función de la transformada de Laplace, por ejemplo para A tomando (21) y (22):
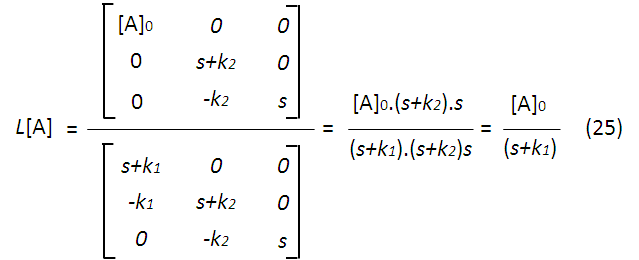
Igualmente procede para las concentraciones de B y C, siendo:
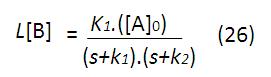
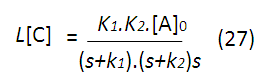
Ahora, para obtener las expresiones de la concentración en función del tiempo aplicamos la función inversa de la transformada de Laplace, pero antes es necesario separar las fracciones, quedando las expresiones anteriores de la siguiente forma:
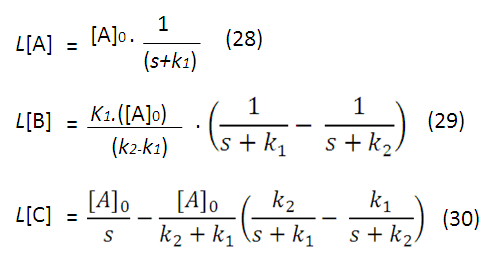
Así es más sencillo realizar la función inversa de la transformada de Laplace para cada ecuación, resultando las siguientes expresiones:
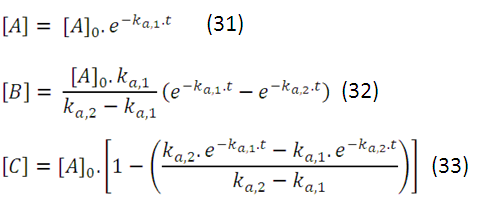
Las ecuaciones (31), (32) y (33) para las concentraciones de cada especie química en función del tiempo coinciden con las indicadas en Levine (pag. 670) para las reacciones consecutivas de primer orden obtenidas por otra vía, en la cual, como pasa en la mayoría de los textos, no describe los detalles del método de integración, quizás por resultar demasiado largo o tedioso para lector.
Hagamos una comprobación de las ecuaciones. Tomemos por ejemplo la descomposición del H2SO4 en un reactor Parr a 500 ºC, la cual procede mediante las siguientes etapas consecutivas:
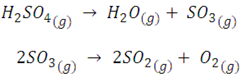
De acuerdo a Barceló (pag. 82) a esta temperatura las constantes de velocidad son k1= 3,33x10-3 min-1 y k2= 2,58x10-3 min-1. En la siguiente figura podemos observar el comportamiento de las concentraciones según el tiempo al considerar una concentración inicial de ácido de 0,05 mol/L.
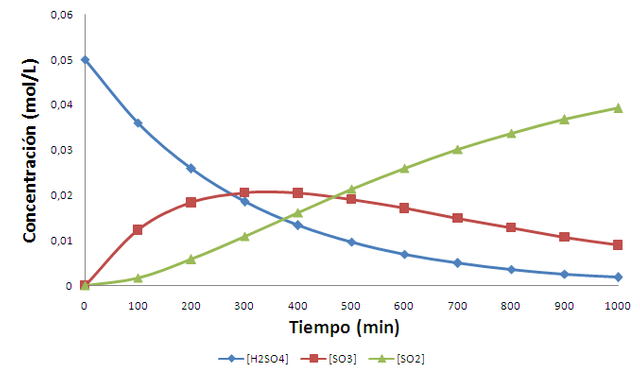
Gráfica de las concentraciones como función del tiempo. Fuente: elaboración propia.
En la figura se aprecia que la concentración de la especie intermedia SO3 aumenta progresivamente en los primeros minutos de la reacción, superando la concentración de H2SO4 y SO3 y alcanzando un máximo cerca de los 300 minutos; después de ese tiempo comienza a decaer dada la menor cantidad disponible de H2SO4 y la continua formación de SO2.
Bueno amigos, hasta aquí la presente publicación. Espero que la información presentada les sirva para ampliar su conocimiento sobre la aplicabilidad de este tipo de operaciones matemáticas que resultan muy útiles para resolver problemas de diferentes ámbitos, como en este caso aplicado a la cinética química. Pues como sabemos, por lo general estudiamos estos métodos de cálculo en ámbitos puramente matemáticos, y este tipo de aplicación le da un sentido físico a la solución de problemas en ingeniería, química y otras áreas al usar esta herramienta.

Referencias
Wikipedia. Transformada de Laplace
Wikipedia. Transformada integral
Levine, I. (2004). Fisicoquímica. Vol. 2, McGraw-Hill.
Barceló, I., Solís, H. (2010). Cinética y catálisis de las reacciones. Universidad Autonoma Metropolitana.
Math foundation!
this is friend, thanks for commenting
You are Welcome Friend!
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Thanks for the support friends
Hi @emiliomoron!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thanks friends!
Saludos @emiliomoron. Un gran articulo el que nos presentas. Agradecido por la referencia a uno de mis trabajos. Me complace saber que fue una iniciativa a tan excelente trabajo. Muy interesante la aplicación de la transformada de Laplace en una reacción química. Mis felicitaciones .
Saludos amigo @lorenzor. Muchas gracias por tu comentario, no podía dejar de hacer la referencia pues la idea surgió al leerlo, me alegra que te haya gustado mi artículo. Saludos!
Hola amigo @emiliomoron, grato saludarte. La transformada de Laplace es muy útil en ingeniería. A nivel de sistemas de control se emplea mucho para el estudio de estabilidad y del análisis de las funciones de transferencia. Te felicito. Votado, y comentado.
Saludos estimado @reyito. Ciertamente este método de calculo encuentra muchas aplicaciones en ingeniería, si lo he tratado en sistemas de control de procesos y también en transferencia de calor, es muy útil para analizar estos sistemas. Muchas gracias por tu comentario y apoyo.
Excelente post! Gracias por compartirlo, saludos.
Muchas gracias @aleestra. Fue un placer.