Observando fenómenos que afectan la solubilidad: Determinación de la solubilidad en presencia de un ion común

La química contempla tópicos muy interesantes, cotidianamente se puede observar la solubilidad de diferentes compuestos, como la sal de mesa (cloruro de sodio), el azúcar (sacarosa) o cualquier otro compuesto similar. Sin embargo, no todos los compuestos presentan una solubilidad alta, por ello algunos son llamados compuestos insolubles. La solubilidad es un concepto bastante relevante para la química, con aplicaciones muy diversas; desde la utilización en la industria de muchas fábricas, hasta las campañas de mercadeo para la publicidad de un nuevo producto, por ejemplo, un detergente. Se presentará en este post, mediante dos experimentos, la influencia ejercida por un ion común en solución, el hidróxido de calcio (Ca(OH)2) y el cloruro de calcio (CaCl2); son compuestos que contienen calcio (Ca), por lo tanto, estando ambos en una solución, cambian el equilibrio de solubilidad del compuesto poco soluble, en este caso el hidróxido de calcio. Fenómeno que no solo sucede con estos compuestos, sino que ocurre en la naturaleza de forma bastante frecuente.
Basamento Teórico del Efecto de Ion común
Algunos compuestos como el NaCl tienen una solubilidad relativamente alta, otros compuestos tienen una solubilidad baja, incluso podría ser despreciable la parte que se disocia en agua, por lo que se tiene a denominar a estos compuestos como insolubles o poco solubles.
Dichos compuestos tienen asociados una constante de productos iónico, o “Kps”, la cual se define como el producto de las concentraciones molares (en equilibrio) de los iones constituyentes, cada una elevada a la potencia del coeficiente estequiométrico en la ecuación de equilibrio balanceada. Dada una disolución general, se infiere que el Kps será:
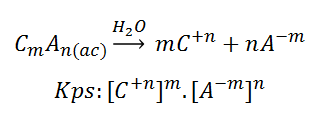
De esta forma se logra calcular la parte solubilizada de un compuesto poco soluble, tomando en cuenta su constante Kps (determinada experimentalmente para un solvente dado, una temperatura y presión especifica). Un ejemplo podría ser el hidróxido de calcio:
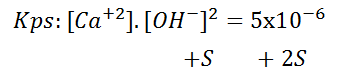
Donde la parte solubilizada es representada por la letra “S” junto con el numero estequiométrico correspondiente, siendo su Kps:
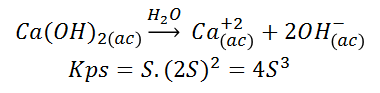
Un efecto que causa una disminución de la solubilidad de un compuesto es el ion común. Cuando se adiciona un compuesto que aporte a la solución un ion en común con otro compuesto poco soluble, por el principio de Le Châtelier, el equilibrio “se desplaza” hacia la izquierda, aumentando la parte del compuesto que queda sin disociarse y por ello la solubilidad disminuye. El valor del Kps de la especie, permanece invariante.
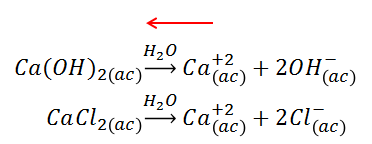
En este caso el ion común es el Ca+2, lo cual disminuye la solubilidad del compuesto insoluble.

Para comprobar los anteriormente dicho, se presentará a continuación, un procedimiento experimental, que comparará de forma cualitativa, la presencia y ausencia de un ion común y su efecto en la solubilidad de un compuesto poco soluble:
Solubilidad del hidróxido de calcio en agua.
En un beaker de 250ml se preparó una solución saturada de Ca(OH)2 con aproximadamente un gramo del mismo y 150ml de agua destilada. Se mezcló con suavidad para permitir que se disolviera la máxima cantidad posible de soluto, y se dejó reposar para que el sólido no disociado pudiera sedimentarse.
Se tomó la temperatura y se procedió a filtrar la solución por el método del doblado simple, siempre cubriendo la solución para evitar una posible carbonatación.
Luego con una solución estandarizada de HCl a 0.0488 M se preparó el sistema para titular la solución antes filtrada, utilizando como indicador el verde de bromocresol (el cual tiene un viraje de amarillo a azul en el intervalo 4,04-5,6 en la escala de pH). Se titularon alícuotas de 25ml de la solución filtrada un total de 4 veces.
Solubilidad del hidróxido de calcio en agua en presencia de CaCl2 (ion común)
En un beaker de 250ml se preparó una solución que contenía aproximadamente 1.5 gramos de cloruro de calcio (CaCl2) y un gramo de Hidróxido de calcio (Ca(OH)2), junto con 150 ml de agua destilada. Se mezcló con suavidad mientras se añadía cada compuesto lentamente y en el orden indicado anteriormente para permitir que se disolviera la máxima cantidad posible de soluto, y se dejó reposar para que el sólido no disociado pudiera sedimentarse.
Se tomó la temperatura y se procedió a filtrar la solución por el método del doblado simple, siempre cubriendo la solución para evitar una posible carbonatación.
Luego con una solución estandarizada de HCl a 0.0488 M se preparó el sistema para titular la solución antes filtrada, utilizando como indicador el verde de bromocresol (el cual tiene un viraje de amarillo a azul en el intervalo 4,04-5,6 en la escala de pH).
Siguiendo el procedimiento anteriormente expuesto, se lograron tabular los siguientes resultados experimentales:
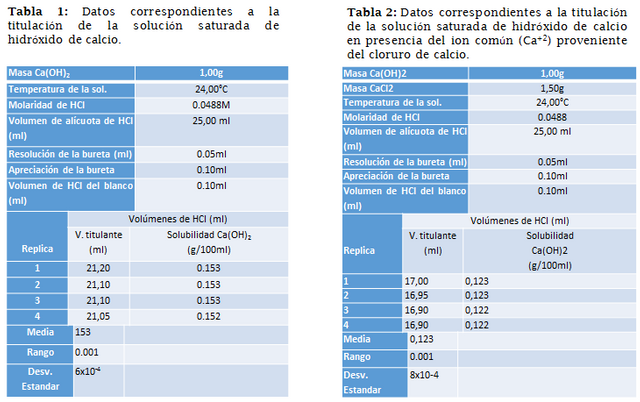
Sabiendo que la solubilidad del hidróxido de calcio a 25° C es de 0.167 g en 100 ml de agua, como las alícuotas son de 25ml, entonces la parte solubilizada corresponde a 0.0418 g. (Valor tomado del CRC HandBook of Chemistry and Physics, 86th Edition, CRC Press 2005)
Según la titulación, los moles titulados de iones oxidrilos corresponden a 1,030(6)x10^(-3) mol en promedio.
Según la reacción de disociación del compuesto, la parte solubilizada del ion oxidrilo es el doble estequiometricamente al hidróxido de calcio, entonces los moles correspondientes al hidróxido de calcio son:
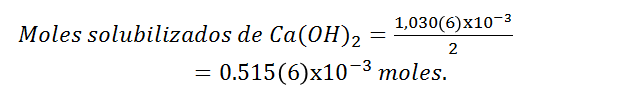
Siendo los gramos de hidróxido de calcio solubilizados:
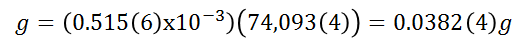
Dicha cantidad corresponde a la solubilidad en 25ml de agua, análogamente para 100 ml la solubilidad será: 0.153(4) g/100ml. Esta cantidad representa un 91,39% de la cantidad teórica para 25°C. Es importante resaltar que la temperatura al momento de realizar la práctica era de 24°C aproximadamente, por lo tanto, estas variaciones de temperatura (ya que pudo aumentar posteriormente) pudieron afectar sistemáticamente las mediciones realizas.
Análogamente a lo realizado anteriormente, se puede calcular, según los datos de la tabla 2, que el valor de solubilidad en esta experiencia es 0.122g/100ml.
Esta cantidad representa un 73,21% de la solubilidad teórica en 100ml de agua, a 25°C y con presencia de un ion común. Es evidente la disminución de la solubilidad del compuesto luego de añadir el Ca+2 como ion común.
Conclusión
Según los resultados obtenidos, fue posible calcular cuantitativamente el efecto del ion común sobre la solubilidad del Ca(OH)2 la cual disminuyo aproximadamente un 20%.
Como la solubilidad es relativa a la temperatura, ésta pudo ser una fuente de errores sistemáticos ya que no era constante, y aunque no era 25°C, pudo variar en el transcurso de la práctica, influyendo así en la solubilidad del compuesto es cuestión.
En síntesis, la técnica de titulación, permitió calcular las concentraciones de los iones oxidrilos, para luego, calcular los gramos solubilizados del compuesto, utilizando la estequiometría y el peso molecular del mismo. Aun con algunos errores sistemáticos asociados fue posible y satisfactoriamente observar cuanto afecta un ion común a la solubilidad de un compuesto.
Espero que esta breve explicación teórica permita entender que la solubilidad de un compuesto, depende de muchos factores, entre ellos el solvente, pero también de los otros componentes que se encuentren en el mismo. Este es uno de mis efectos favoritos, y considero que se manifiesta muchas veces tanto en la Química experimental como en la naturaleza. Gracias por leer.
Referencias:
Todas las imágenes de mi autoría, fueron editadas y procesadas utilizando el programa PowerPoint 2016.
- Theodore Brown, Eugene LeMay, Bruce Bursten, Julia Burdge, (2004), Quimica. La ciencia central. (9° Edición). Pearson Educación, S.A., Capitulo 17.
Douglas Skoog, Donald West y James Holler (2006) Fundamentos de Química Analítica (4ta Edición) Editorial Reverté.
CRC HandBook of Chemistry and Physics, 86th Edition, CRC Press 2005

Posted from my blog with SteemPress : http://aleestra.vornix.blog/observando-fenomenos-que-afectan-la-solubilidad-determinacion-de-la-solubilidad-en-presencia-de-un-ion-comun/
Muy buena publicación @aleestra. La solubilidad es una propiedad muy importante en la industria química, ya he trabajado algunas aplicaciones donde debemos controlar este factor. Saludos!
Gracias @emiliomoron! Una separación por solubilidad es bastante sencilla en teórica, pero en practica (a pequeña escala) tiende a complicarse, precisamente por la gran cantidad de variables que pueden afectar la solubilidad. Gracias por tu comentario, saludos 👍.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Muchas gracias por el apoyo!
Hi @aleestra!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Apoyado por el trail "Orincones"
Ven y unete en el canal de Discord ¡Te esperamos!