La naturaleza del aire y los experimentos de Antoine Laurent Lavoisier ( Año: 1774)
Hola amigos steemianos, hoy vamos a estudiar una mezcla de gases que es vital para la vida en la Tierra, se trata del "Aire", el cual es transparente y se manifiesta por los vientos y también cuando algunos cuerpos se desplazan a altas velocidades; el aire es lo que conocemos como la atmósfera la cual rodea toda la Tierra.
Definición del aire :
El aire es una mezcla homogénea compuesta principalmente por dos gases, oxígeno (símbolo O ) y nitrógeno (símbolo N ), que constituye la atmósfera de la Tierra, la cual permanece alrededor del planeta por acción de la fuerza de la gravedad y es esencial para la vida en el planeta. El aire contiene 78% de nitrógeno, 21% de oxígeno y también contiene otros elementos que representan el 1%.

Fuente
Pero para entender lo que es el aire y de sus componentes, es necesario estudiar su naturaleza, y para ello es de gran importancia conocer los experimentos realizados por el químico, biólogo y economista francés, Antoine-Laurent Lavoisier (nació en París el 16 de agosto de 1743). Un personaje de la ciencia, considerado el padre de la química moderna y quien se volvió inmortal por su teoría química del aire.

Fuente
Naturaleza del aire
La verdadera naturaleza del aire solo se conoció en 1774, cuando Lavoisier lo descubrió durante el curso de un famoso experimento que a continuación vamos a resumir:
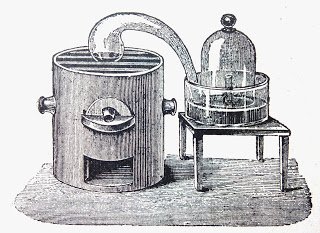
Fuente
A. Si se vierte mercurio en una retorta cuyo tubo de desprendimiento llega a una campana llena de aire que descansa sobre el mercurio, y se calienta esta retorta durante seis días y seis noches, podremos observar lo siguiente:
- El mercurio de la retorta se cubre de finas escamas de color rojo anaranjado.
- El mercurio del cristalizador asciende en el interior de la campana, lo que prueba que una parte del gas contenido en dicha campana ha desaparecido.
Si se continúa calentando durante un tiempo igual al primero, no se produce ningún fenómeno nuevo.
B. Si se deja de calentar el gas que queda en la campana, podrá comprobarse que se trata de un gas que no es combustible ni comburente, y además con densidad un poco más baja que el aire, este gas es nitrógeno.
C. Si se recogen las escamas de color rojo anaranjado y se calientan en otra retorta cuyo tubo de desprendimiento vaya a una probeta llena de agua, se verá aparecer mercurio en la retorta mientras que en la probeta se desprende un gas; este gas revive la llama de un cerillo que solo lo presentará en un punto de ignición; no siendo este combustible y además más pesado que el aire, este gas es Oxígeno . Las escamas rojas eran una combinación de oxígeno y mercurio; óxido de mercurio (2Hg + O2 ➡ 2HgO). El volumen de aire desprendido representa exactamente el volumen de gas que desapareció durante la primera parte del experimento.
Conclusión: El aire es una mezcla de dos gases: oxígeno (O) y nitrógeno (N).
Análisis de aire
A continuación vamos a realizar unanalisis del aire en base al volumen y al peso:
En volumen: como el experimento de Lavoisier es largo, delicado e incompleto, puede emplearse un cuerpo capaz de combinarse con oxígeno con mayor rapidez que el mercurio, es decir que tenga mayor afinidad por el oxigeno. En este caso se practica un experimento llamado "del fósforo caliente".
El método consiste en introducir en el aparato 100 cm3 de aire, quedando después de la experiencia 79 cm3 de un gas que se reconoce como nitrógeno. Por lo tanto, 100 cm3 de aire contienen 21 cm3 de oxígeno y 79 cm3 de nitrógeno.
Análisis del aire en peso:
El método de análisis del aire en peso, imaginado por Dumas y Boussingault, es más preciso que los antes mencionados, consiste, en principio, en la absorción de oxígeno del aire por el cobre calentado, el cobre se pesa antes y después del del experimento; obteniéndose por deducción, el peso del oxígeno absorbido. También se pesa el nitrógeno que se libera del oxígeno de la siguiente manera: se produce previamente el vacío en el aparato y luego se pesa; el aire se deja entrar lentamente, este va a perder oxígeno cuando pasa a través de cobre caliente y el aparato se llena de nitrógeno, luego al final del experimento se vuelve a pesar el aparato y se obtiene el peso del nitrógeno que ha entrado, de esta nueva cifra se deduce el peso del aparato vacío y el peso del oxigeno absorbido por el cobre.
En el resultado de estos experimentos, se obtuvieron las siguientes cifras: para 100 en peso, el aire contiene 23.13 de oxígeno y 76.87 de nitrógeno.
Nitrógeno Atmosférico
El nitrógeno es un elemento que junto con el oxígeno está presente en la mezcla que forma el aire . Como lo demostró Lavoisier, en sus experimentos, el nitrógeno atmosférico es un gas que permanece después de separar el oxígeno del aire.
El nitrógeno es el gas que Lavoisier obtuvo durante la oxidación del mercurio caliente. Lavoisier consideró que el nitrógeno tenía ciertos efectos y dijo que si un ave o un ratón, se llegaban a colocar bajo una campana llena de este gas, morían de inmediato; también afirmaba que una vela encendida se apagaba instantáneamente en este gas; demostrando de así, que no es adecuado para la respiración o la combustión.
Otros elementos presentes en el aire.
En los análisis anteriores no se han mencionado algunos elementos y sustancias que también contiene el aire; y es que además del oxígeno y el nitrógeno, el aire también contiene muchos sólidos: tales como: el polvo mineral de varios tipos, como organismos microscópicos vivos, también restos orgánicos; líquidos : como gotas de lluvia, neblina; gases: vapor de agua cuya proporción varía mucho con la temperatura, dióxido de carbono en una proporción casi constante e igual a 3 / 10,000 en volumen, trazas de amoniaco, ozono, y compuestos oxigenados del nitrógeno.
Además de lo anterior, el aire también contiene algunos gases que son difíciles de aislar, los cuales representan el 1% de todos esos elementos gaseosos y tienen aplicaciones en la industria; estos son: el helio, que es un elemento ligero incombustible que se usa para inflar globos; el neón , que se utiliza en los anuncios luminosos; otra es el argón y criptón , que se usan dentro de las bombillas, y el xenón .
Características y propiedades del aire
El aire posee muchas características y propiedades, entre ellas tenemos:
- Un litro de aire seco a 0 ° a presión normal pesa 1.2935 g.
- El aire ocupa un lugar en el espacio.

Fuente - El aire se caracteriza por ser: elástico, inodoro, incoloro en pequeñas cantidades y en masas mayores toma un color azulado.
- Pesa menos que el agua.
- Es de menor densidad que el agua.
- Tiene volumen indefinido.
- No existe en el vacío.
- Es incoloro, inodoro e insípido (Cuando no esta contaminado).
- El aire reacciona con la temperatura condensándose en hielo a bajas temperaturas y produce corrientes de aire.

Fuente
- El aire esta compuesto por varios elementos entre ellos el oxigeno (O2) y el dióxido de carbono elementos básicos para la vida.
