Respuesta mecánica del músculo gastrocnemio y actividad cardíaca en Rhinella marina sometidos a diferentes condiciones de estimulación
El movimiento y el funcionamiento de la mayoría de los sistemas fisiológicos de los vertebrados dependen de la generación de contracciones musculares. Así, el sistema nervioso-motor mueve a los animales a través de la coordinación con los músculos esqueléticos, los músculos lisos y el músculo cardíaco. En el presente estudio, se describe la determinación de la respuesta mecánica del músculo gastrocnemio de Rhinella marinaen términos de longitud y tiempo de respuesta, ante estímulos mecánicos y/o eléctricos a diferentes concentraciones de Ca+2. Evidenciando además las respuestas de tetanización y fatiga. Con los resultados fue posible construir las curvas longitud-tensión y tiempo de reacción-tensión del músculo. De la misma manera, se presenta la evaluación del efecto de la acetilcolina y epinefrina y de la drogas lidocaína y atropina en la actividad cardíaca de Rhinella marina. Los resultados indicaron que solo la lidocaína ejerce un efecto sobre la actividad cardíaca llevándola hasta 28,7 ± 7,6 pul/min respecto de la actividad cardíaca basal de 41,4 ± 4,7 pul/min. Finalmente, se observó la anatomía interna del corazón y el efecto de la descoordinación entre sus zonas marcapaso.
1. INTRODUCCIÓN
En los animales todo proceso fisiológico viene dado por el funcionamiento en conjunto de distintas células integradas en tejidos, las cuales requieren de nutrientes y algunos gases como el oxígeno para obtener energía. En aquellos en los que los cuerpos se volvieron más grandes y la anatomía más compleja (ambas cosas independientemente), fue necesario desarrollar un método eficiente para distribuir dichos gases y nutrientes hasta todas las células de los distintos sistemas y las sustancias de desecho fuera de estos. Está necesidad derivó en la aparición y evolución de los sistemas circulatorios (Hill et al., 2006; Randall et al., 1999). En los vertebrados el sistema circulatorio consta de un órgano muscular impulsor, conocido como corazón o músculo cardíaco, cuya función general es la de bombear la sangre hasta las diferentes regiones del cuerpo valiéndose de arterias, venas, capilares y vasos sanguíneos (Hill et al., 2006).
El músculo cardíaco, se encuentra inervado por el sistema nervioso autónomo, por lo cual la sinapsis regulatoria es de tipo química e involucra a sustancias químicas denominadas neurotransmisores, que ejercen un determinado efecto relacionado mayormente a la velocidad de contracción del músculo cardíaco. Particularmente, este se caracteriza por ser un músculo estriado constituido de fibras mononucleadas, ramificadas y con muchas uniones celulares de tipo hendidura. Sin embargo, a pesar de su peculiaridad el mecanismo de contracción es el mismo que en el resto de la musculatura estriada esquelética, inervada por el sistema nervioso somático, cuyas células son más bien grandes, cilíndricas, multinucleadas y sin uniones de tipo hendidura (Lodish et al., 2016; Hill et al., 2006). Dicho mecanismo de contracción consiste en el deslizamiento de filamentos gruesos de miosina sobre filamentos delgados de actina (dentro de unidades o paquetes denominados sarcómeros) ambos unidos a una matriz proteica que a su vez se une al citoesqueleto de las fibras musculares y permite que estas se contraigan. Generando así la contracción de los paquetes musculares que mueven al esqueleto y bombean la sangre (Hill et al., 2006).
A groso modo, el proceso comienza cuando una neurona motora transmite un potencial de acción en la placa motora (unión neurona-músculo) el cual despolariza la membrana celular de las fibras musculares (sarcolema). Esta despolarización se propaga por invaginaciones de la membrana (túbulos T) que penetran en la fibra muscular y se conectan con un sistema de endomembranoso denominado retículo sarcoplasmático (RS), y resulta en la liberación de grandes cantidades de calcio (Ca+2) al citoplasma. Una vez que el Ca+2 llega a los sarcómeros, este se une a una de las dos proteínas asociadas con los filamentos delgados de actina, llamada troponina. Esta última, al unirse al Ca+2 mueve a la segunda proteína llamada tropomiosina y expone los sitios de unión a miosina en la cadena de actina.
Posteriormente, las cabezas de los filamentos gruesos de miosina, ya acoplados a adenosin trifosfato (ATP), se unen a la actina en los sitios expuestos, formando los puentes cruzados e hidrolizando al ATP. Finalmente, las cabezas de miosina se doblan hacia el centro del sarcómero, moviendo también a los filamentos delgados en la misma dirección unos 10 nm y haciendo que los sarcómeros se acorten en tamaño y se genere la contracción de la fibra muscular y por consiguiente del paquete muscular. El Ca+2 es de nuevo secuestrado por el RS y la unión de ATP a las cabezas de la miosina interrumpe la interacción miosina-actina, relajando al sarcómero y a las fibras, que vuelven a su tamaño original (Hill et al., 2006).
En el presente estudio se describe la evaluación de la respuesta mecánica del músculo gastrocnemio de Rhinella marinaa la aplicación de fuerza sobre éste usando peso, con y sin estimulación eléctrica y siendo sometidos a concentraciones diferenciales de Ca+2. A partir de esto, se construyeron las curvas longitud-tensión y tiempo de respuesta-tensión. Además se evidenciaron los procesos de tetanización y fatiga. Por otra parte, se describe la determinación del efecto de la lidocaína y de los neurotransmisores epinefrina, acetilcolina, atropina en la actividad cardíaca, también de Rhinella marina. Finalmente, se estudió la morfología interna del corazón y la importancia de las zonas marcapasos mediante ligaduras.
2. MATERIALES Y MÉTODOS
Se emplearon un total de tres ejemplares silvestres de Rhinella marinay tanto los procedimientos para descerebrar y desmedular, extracción y montaje del músculo gastrocnemio y exposición y disección del músculo cardíaco, como los del resto de los experimentos que se describen a continuación se realizaron siguiendo lo establecido en la “Guía de prácticas de fisiología animal” (Andara & Sánchez, 2016). Los análisis estadísticos y gráficas se produjeron empleado el software libre PAST 3.1.
2.1. Respuesta mecánica del músculo gastrocnemio a diferentes condiciones de estimulación
Para todos los experimentos relacionados al músculo gastrocnemio se emplearon cuatro músculos y cada uno se sometió a concentraciones diferenciales de CaCl2 en soluciones de ringer vertebrado. Siendo estas 0,5, 2 y 6 mM de CaCl2 , y 100 mM de EDTA. Los músculos fueron dejados durante 10 min sumergidos en la solución correspondiente y se les bañó con ella constantemente el resto del tiempo.
2.1.1. Longitud del músculo ante diferentes tensiones
Empleando un vernier se determinó la longitud inicial del músculo, luego de esto se colocaron de manera independiente arandelas de 10 g hasta llegar a 40 g , determinando la longitud del músculo en cada caso y esperando al menos 1 min entre cada medición. Luego de esto se realizó el mismo procedimiento, pero quitando las arandelas de una en una hasta que no hubiese ninguna colgando del músculo. Con base en las longitudes medidas se realizó la curva longitud-tensión, en la que la tensión es igual a la fuerza aplicada sobre el músculo, la cual a su vez es el resultado de la masa de las arandelas multiplicada por la aceleración de gravedad. Las tensiones son expresadas no en Newton sino en porcentaje de la máxima tensión aplicada para fines prácticos.
2.1.2. Tiempo de reacción del músculo ante diferentes tensiones y estimulación eléctrica
Se llevó acabo el mismo procedimiento antes descrito en cuanto a la adición y sustracción de peso impuesto al músculo por medio de las arandelas, pero sin medir la longitud. En cada caso se usó un estimulador eléctrico aplicando estímulos de 0,5 V de intensidad y 4 ms de duración, y registrando el tiempo de respuesta o reacción del músculo ante el estímulo con un cronómetro. Los tiempos registrados permitieron la elaboración de la curva tiempo de reacción-tensión.
2.1.3. Tetanización y fatiga
Con la finalidad de evidenciar las respuestas de tetanización y fatiga se sometió al músculo a estímulos eléctricos de 11 V con una frecuencia de 4 pulsos por segundo. Se tomó el tiempo que tardó el músculo en dejar de relajarse y el tiempo en el que dejó de responder a los estímulos.
2.2. Actividad cardíaca en presencia de lidocaína y de neurotransmisores
Una vez expuesto el corazón, este se bañó constantemente con ringer batracio y se determinó la frecuencia cardíaca basal contando el número de pulsaciones por minuto. Luego de esto se procedió a determinar la frecuencia cardíaca al agregar tres gotas de epinefrina 5 μM en el seno venoso y en el ventrículo. Se agregaron las gotas en una región y luego de 5 s se determinó el número de pulsaciones por minuto. Inmediatamente luego de esto se lavó el corazón con abundante solución ringer y se esperaron 5 min para aplicar ahora la epinefrina en el ventrículo y determinar la frecuencia cardíaca de igual manera. El mismo procedimiento se llevó a cabo para determinar las frecuencias cardíacas en respuesta a la aplicación en el seno venoso de acetilcolina 5 μM , atropina 50 μM y acetilcolina luego de aplicar atropina, cuidando esperar 5 min entre aplicaciones y lavando bien el corazón y los alrededores con ringer.
Después de 10 min de reposo, se aplicaron 3 gotas de lidocaína sobre el corazón y se registró la frecuencia cardíaca. Luego de 10 min se determinó de nuevo la frecuencia cardíaca. Se lavó y se dejó el corazón en reposo. Los resultados se expresan en gráficos de barra y se compararon estadísticamente mediante las pruebas de Kruskall-Wallis y Mann-Whitney por pares, con un 95% de confiabilidad (α=0,05).
2.3. Estudio de las zonas marcapaso y morfología interna del corazón
Para identificar las zonas marcapaso de corazón se realizaron ligaduras empleando hilo encerado y amarrándolo mediante un nudo doble en zonas específicas de manera que presionara un poco al corazón pero sin cortarlo. La primera se realizó entre el seno venoso y la aurícula derecha. La segunda se realizó manteniendo la primera, y luego anudando por el límite entre las aurículas y el ventrículo. En la tercera ligadura se desató la primera realizada. En todos los casos se registró lo observado.
Finalmente, se aisló el corazón cortando la comunicación con los vasos sanguíneos y se pesó. Luego de esto se realizó un corte longitudinal y se identificaron las cámaras presentes en el corazón y su tamaño.
3. RESULTADOS Y DISCUSIÓN
3.1. Longitud del músculo ante diferentes tensiones
Las longitudes registradas se muestran en la figura 1. En esta se puede observar que el músculo sometido a 6 mM de CaCl2 fue el que alcanzó mayor longitud cuando se aplicó la máxima fuerza sobre éste. Por el contrario el músculo en EDTA se mantuvo todo el tiempo en un valor cercano al inicial en cuanto a longitud, y terminando en un valor aún más bajo. En el músculo a 2 mM de CaCl2 se alcanzó la segunda máxima longitud al aplicar la máxima tensión, y nuevamente al quitar toda tensión la longitud del músculo fue menor que la inicial. Finalmente, el músculo a 0,5 mM de CaCl2 presentó un aumento y disminución simétrico en todas las tensiones, pero valor máximo obtenido de longitud fue menor que en el resto de los casos.
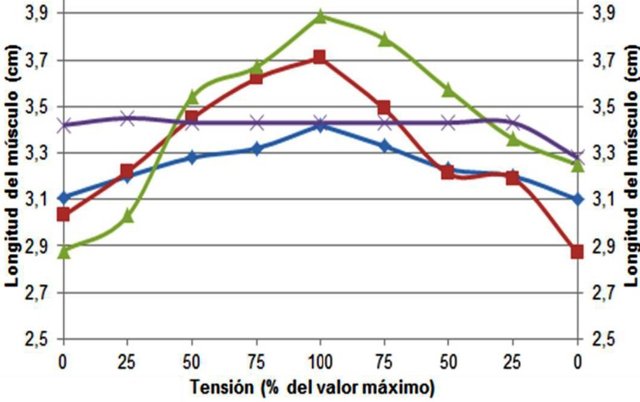
Figura 1. Curva longitud-tensión del músculo gastrocnemio a diferentes concentraciones de CaCl2.
Todos los músculos alcanzaron la máxima longitud cuando se les aplicó la máxima fuerza. En algunos casos la longitud final fue menor que la inicial. En este último, la máxima longitud alcanzada fue menor que en el resto.
Los hechos observados pueden explicarse mayormente con base en los tratamientos que se realizaron en los distintos músculos. En el caso del músculo con EDTA, no existían iones de Ca+2 libres en las fibras musculares ya que este es un agente secuestrador de iones o quelante (Hart, 2005). Al no haber Ca+2 disponible en las fibras, no se pueden formar los puentes cruzados entre la miosina y la actina, ya que la troponina no puede exponer los sitios de unión a miosina de los filamentos de actina. Es por esto que el músculo sometido a EDTA presenta siempre una longitud igual a la inicial, es decir, no genera tensión ni trabajo en ningún momento. Por su parte, el músculo sometido a 0,5 mM de CaCl2 ya presenta concentraciones de Ca+2 suficientes para generar contracción de los sarcómeros, y es por esto que al aumentar y disminuir la tensión se observan cambios en la longitud del músculo (Hill et al., 2006).
En el músculo con 2 mM de CaCl2 las concentraciones de Ca+2 disponibles son tales que permiten un mayor estiramiento del músculo, por lo que se observa que hay una mayor longitud en la máxima tensión y que el músculo luego es capaz de contraerse de nuevo a longitudes cercanas a las iniciales. Similarmente, el músculo en 6 mM presentó aun mayor longitud en la máxima tensión que el resto, a pesar de que era el músculo más pequeño inicialmente. Esto se debe a que en este músculo las concentraciones de Ca+2 eran mayores que en el resto, y por tanto se pudieron formar mayor cantidad de puentes cruzados, permitiendo al músculo alargarse y acortarse aún más que en el resto, generando más trabajo (Hill et al., 2006). En todos los casos se esperaba que la longitud final fuese menor o igual que la inicial, producto de la fatiga, por lo que en los casos en los que se observó lo contrario pudo haber errores en la medición.
3.2. Tiempo de reacción del músculo ante diferentes tensiones y estimulación eléctrica
En el músculo con EDTA el tiempo de reacción fue siempre el mismo (Fig. 2). En contraste los tiempos de reacción para el resto de los músculos fueron variados. En el músculo con 0,5 mM de CaCl2 los tiempos de reacción fueron más bajos que en el resto de los casos, y en el valor máximo de tensión no se observó respuesta, por lo que el tiempo de reacción fue cero. Por su parte en el músculo con 2 mM de CaCl2 se observaron los tiempos de respuesta mayores, tardando bastante en responder a la estimulación cuando la tensión fue máxima.
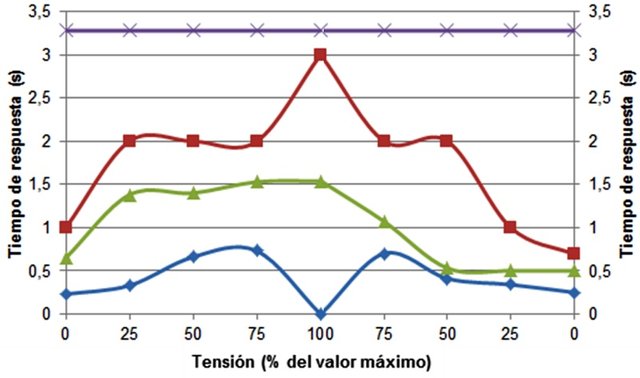
Figura 2. Tiempo de respuesta de los músculos ante tensión y un estímulo eléctrico bajo diferentes concentraciones de Ca+2.
En el músculo en 6 mM de CaCl2 la velocidad de las respuestas fueron aumentando y disminuyendo de manera progresiva a medida que se aumentaba y disminuía la tensión respectivamente, y las velocidades fueron siempre intermedias entre los músculos a 0,5 y 2 mM. El hecho de que en el músculo a 0,5 mM no se haya observado contracción en la máxima tensión, puede deberse a que se dio una contracción de tipo isométrica, en la que el músculo no cambió de longitud (Hill et al., 2006) pues el peso se lo impidió.
Lo observado en el músculo con EDTA se debe nuevamente a que al ser un agente quelante, este secuestra la mayor parte del Ca+2 disponible para que se generen las contracciones, con lo cual podría esperarse que estas no se den (Hill et al., 2006). Sin embargo se observaron contracciones lentas y siempre a la misma velocidad probablemente debido a que el EDTA no logró secuestrar todo el Ca+2 disponible en el retículo sarcoplasmático de las fibras musculares y por eso si se observaron contracciones. A pesar de que se hayan observado contracciones lentas, el hecho de que se hayan dado siempre a la misma velocidad es inusual pues sugiere que las contracciones eran independientes de la tensión, y esto no se observó en los demás casos, lo cual invita a pensar que hubo algún error durante las mediciones.
En los músculos con diferentes concentraciones de Ca+2 no se observó una relación proporcional entre los niveles de calcio y la velocidad de contracción. Así, el músculo en 0,5 mM fue el más rápido en contraerse seguido por el de 6 mM, y finalmente por el de 2 mM. Esto puede explicarse de dos posibles formas. La primera, es suponiendo que al haber poco Ca+2 disponible, la contracción se da más rápido pues no se contrae todo el músculo sino una pequeña parte de este. Luego, en el caso del músculo en 6 mM hay el suficiente Ca+2 como para que se produzca una contracción mayor y más rápida, mientras que en el músculo 2 mM no hay tanto Ca+2 disponible y por esto se tarda más en relación que las otras dos. La segunda forma de explicarlo, es asumiendo que la velocidad de las contracciones del músculo sea menos dependiente de las concentraciones de Ca+2 y más de otros factores como la longitud del músculo. En todo caso, se recomienda realizar el experimento de nuevo en condiciones más controladas para disminuir al máximo los posibles errores.
3.3. Tetanización y fatiga
Las frecuencias de estimulación altas indujeron el estado de contracción tetánica en los músculos, en el cual estos dejan de relajarse y se mantienen siempre contraídos. Esto se debe a que la velocidad a la que se libera Ca+2 del retículo sarcoplasmático es mayor a la que este lo secuestra, producto de la estimulación. Al haber calcio siempre disponible, los músculos se mantienen contraídos, hasta que alcanzan el estado de fatiga en el que liberan la tensión, pues el factor limitante deja de ser el Ca+2 y es ahora el ATP, que al agotarse impide que el músculo siga respondiendo a los estímulos (Hill et al., 2006).
Los tiempos de tetanización y de fatiga se muestran en la tabla I en conjunto con los pesos de los músculos. Se observa que los músculos en 0,5 mM y en EDTA alcanzaron rápidamente el estado de tetanización, y luego unos segundos después se fatigaron. En los músculos a 2 y 6 mM también se observa que la tetanización se alcanzó antes y unos segundos más tarde se fatigaron. Sin embargo, la diferencia entre los primeros dos y estos es muy grande en cuanto a tiempo y esto no se puede explicar en función de las concentraciones de Ca+2 ya que el tiempo de tetanización es de alguna forma independiente de la abundancia del calcio. Este último determina si se da o no la contracción y si se alcanza la tetanización, pero no qué tan rápido se da esta. Al observar los pesos, tampoco parece haber una relación lógica entre ellos y el la velocidad a la que se alcanza la tetanización y la fatiga.
La única forma de explicar los resultados es que las frecuencias y/o las intensidades de estimulación no fueron realmente las mismas para los distintos músculos, y por eso en algunos casos se alcanzó la tetanización más rápido y en otros más lento. Se recomienda realizar el experimento en condiciones de estimulación iguales para cada músculo.
Tabla I. Tiempo de tetanización, fatiga y pesos de los músculos a diferentes concentraciones de Ca+2.
| Condición | Peso del músculo (g) | Tiempo de tetanización (seg) | Tiempo de fatiga (seg) |
|---|---|---|---|
| 0,5 mM CaCl2 | 2,165 | 1,33 | 6,33 |
| 2 mM CaCl2 | 2,150 | 88,00 | 140,00 |
| 6 mM CaCl2 | 1,702 | 120,00 | 180,00 |
| EDTA | 1,542 | 1,87 | 6,39 |
3.4. Actividad cardíaca en presencia de lidocaína y de neurotransmisores
La prueba de Kruskal-Wallis permitió determinar que al menos uno de los tratamientos con neurotransmisores difería del resto (α<0,05). Por su parte el estadístico de Mann-Whitney indicó que solo existían diferencias en cuanto a la frecuencia cardíaca después del tratamiento con lidocaína respecto de la actividad basal. En este sentido la actividad cardíaca basal fue de 41,4 ± 4,7 pulsaciones por minuto (pul/min) y en presencia de lidocaína de 28,7 ± 7,6 pul/min. El resto de los tratamientos fueron iguales entre si e iguales respecto de la actividad cardíaca basal (Fig. 3).
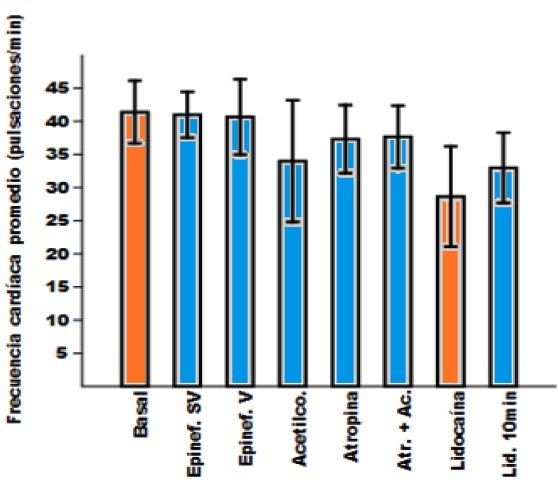
Figura 3. Frecuencia cardíaca promedio en función de distintos tratamientos.
Se muestran las frecuencias cardíacas promedios, con su desviación estándar en el estado basal (Basal), en presencia de epinefrina en el seno venoso (Epinef. SV) y el en ventrículo (Epinef. V), en presencia de acetilcolina (Acetilco.), atropina (Atropina), acetilcolina después de aplicar atropina (Atr. + Ac.), y finalmente en presencia de lidocaína (Lidocaína) y 10 min después de la aplicación de esta (Lid. 10 min). Solo se encontraron diferencias entre la actividad cardíaca en presencia de lidocaína respecto a la basal (barras anaranjadas), el resto fueron todas iguales entre si y respecto a la basal (barras azules).
La lidocaína es un agente anestésico local cuyo mecanismo de acción consiste en bloquear los canales de sodio dependientes de voltaje (Clarkson & Hondeghem, 1985), así evitando que se generen potenciales de acción locales, y por tanto impidiendo que se den las contracciones musculares en la zona afectada. En este caso, al aplicarla al corazón la lidocaína en efecto causó una disminución del número de contracciones por minuto respecto de la actividad basal. La lidocaína se caracteriza por poseer un efecto rápido (Clarkson & Hondeghem, 1985), lo cual de alguna manera explica que luego de tan solo 10 min ya la actividad era igual que en la actividad basal.
Por su parte, la epinefrina es una hormona neurotransmisora secretada por el sistema nervioso simpático, que aumenta el ritmo cardíaco entre otras cosas, para preparar al cuerpo para reaccionar ante situaciones de peligro, ejercicio o amenaza. La acetilcolina, también un neurotransmisor, posee receptores nicotínicos en el corazón lo cuales causan potenciales post-sinápticos inhibitorios que resultan en la disminución del ritmo cardíaco. De manera contraria la atropina es una droga que actúa como anticolinérgico, ya que se une a los receptores de acetilcolina, pero resulta más bien en el aumento del ritmo cardíaco (Hill et al., 2006). El hecho de que no se hallan observado diferencias entre los tratamientos con los neurotransmisores antes mencionados respecto de la actividad basal, puede deberse mayormente a que las concentraciones de las sustancias empleadas fueron muy bajas. Por otra parte, se recomiendo emplear una muestra más grande, o al menos realizar más réplicas para que el análisis estadístico sea representativo.
3.5. Estudio de las zonas marcapaso y morfología interna del corazón
Las zonas marcapasos son zonas en el corazón con células capaces de generar potenciales de acción de manera espontánea, ya que los estos inician por hiperpolarización en vez de despolarización (Hill et al., 2006). Al realizar la primera ligadura se observó que las contracciones en el seno venoso se coordinaron respecto a las contracciones en la zona de las aurículas, latiendo al mismo momento. Luego de esto en la segunda ligadura, ocurrió que las contracciones entre todas las zonas del corazón se volvieron simultáneas. Finalmente, en la tercera ligadura, las contracciones entre la zona del ventrículo y las aurículas se daban de manera simultánea. Esto se puede explicar ya las zonas marcapasos están coordinadas unas con otras mediante la propagación de los potenciales de acción. Así, cuando una zona inicia un potencial de acción, la otra lo inicia tan pronto como llega el de la primera zona. Al estar aisladas de alguna forma por la ligadura, los potenciales de acción en las zonas marcapasos se generan de manera espontánea al mismo ritmo y por tanto se observa una contracción simultánea anormal (Hill et al., 2006).
Al abrir el diseccionar longitudinalmente al corazón se observó que este consta de una zona con abundantes cámaras en el centro constituido por el seno venoso, entre dos cámaras laterales denominadas aurículas. Finalmente, se observó una cámara en la zona baja del corazón, denominada ventrículo (Hill et al., 2006).
4. CONCLUSIONES
• Los músculos en presencia de EDTA al 100 mM no son capaces de generar distención ni contracción.
• A medida que aumentan las concentraciones de Ca+2 los músculos son capaces de generar mayor distención y contracción, es decir son capaces de generar mayor trabajo.
• El tiempo de reacción ante un estímulo eléctrico y ante tensión para el músculo en EDTA fue el más lento de todos y fue constante o independiente de la tensión.
• El tiempo de reacción más rápido fue el del músculo en 0,5 mM de CaCl2, seguido por el músculo en 6 mM de CaCl2, y finalmente por el músculo en 2 mM.
• En todos los casos se evidenció la tetanización y la fatiga. Los músculos sometidos a 0,5 mM de CaCl2 y EDTA alcanzaron la tetanización a los 1,33 y 1,87 s respectivamente. La fatiga la alcanzaron a los 6,33 y 6,39 también respectivamente.
• Los músculos en 2 mM y 6 mM de CaCl2 alcanzaron la contracción tetánica a los 88 y 120 s respectivamente. Mientras que la fatiga la alcanzaron a los 148 y 180 s también respectivamente.
• La lidocaína disminuye el ritmo cardíaco hasta 28,7 ± 7,6 pul/min respecto de la actividad cardíaca basal de 41,4 ± 4,7 pul/min.
• No se encontraron diferencias en los tratamientos con acetilcolina, atropina y epinefrina respecto de la actividad basal.
• Al impedir la comunicación entre las zonas marcapasos del corazón, se dan contracciones de estas zonas en simultáneo.
• El corazón de Rhinella marina consta de dos aurículas, un seno venoso y un ventrículo.
5. REFERENCIAS BIBLIOGRÁFICAS
• Andara, C. & E. Sánchez. Guía de prácticas de fisiología animal. (2016). Universidad de Carabobo, Facultad de Ciencias y Tecnología, Departamento de Biología. Carabobo, Venezuela. 71 pp.
Clarkson, C. & L. Hondeghem. (1985). Mechanism for bupivacaine depression of cardiac conduction: fast block of sodium channels during the action potential with slow recovery from block during diastole. Anesthesiology. 62(4): 396-405.
• Hart, R. (2005). Ethylenediaminetetraacetic Acid and Related Chelating Agents. Ullmann's Encyclopedia of Industrial Chemistry. Alemania. 700 pp.
• Hill, R., G. Wyse, & M. Anderson. (2006). Fisiología animal. Editorial Médica Panamericana S.A. Madrid. 916 pp.
• Lodish, H., A. Berk, C. Kaiser, M. Krieger, A. Bretscher, H. Ploegh, A. Amon & K. Martin. (2016). Molecular Cell Biology. W. H. Freeman and Company. New York. 1106 pp.
• Randall, D., W. Burggren & K. French. (1999). Eckert: Fisiología animal. Mecanismos y adaptaciones. McGraw-Hill Interamericana. Madrid, España. 790 pp.
• Hart, R. (2005). Ethylenediaminetetraacetic Acid and Related Chelating Agents. Ullmann's Encyclopedia of Industrial Chemistry. Alemania. 700 pp.
• Hill, R., G. Wyse, & M. Anderson. (2006). Fisiología animal. Editorial Médica Panamericana S.A. Madrid. 916 pp.
• Lodish, H., A. Berk, C. Kaiser, M. Krieger, A. Bretscher, H. Ploegh, A. Amon & K. Martin. (2016). Molecular Cell Biology. W. H. Freeman and Company. New York. 1106 pp.
• Randall, D., W. Burggren & K. French. (1999). Eckert: Fisiología animal. Mecanismos y adaptaciones. McGraw-Hill Interamericana. Madrid, España. 790 pp.
Hola @khrisaeroth tu post ha sido seleccionado para ser curado por el Proyecto Witness Cervantes. Deseamos sigas haciendo post como estos.
Saludos, muchísimas gracias. Así seguiré.