Hibridación de orbitales atómicos. Hibridación tipo sp.
Saludos mis estimados amigos de steemit.
En esta ocasión quiero dar continuidad con el tema de hibridación de orbitales atómicos abordando finalmente el caso de la hibridación sp, el tercer tipo de hibridación que puede experimentar un átomo como el carbono.
A diferencia de los casos comentados anteriormente, la hibridación sp, también llamada digonal, consiste en la hibridación del orbital s únicamente con uno de los tres orbitales p. En este caso, así como en los otros que hemos estudiado, los orbitales híbridos resultantes son bilobulares, orientados en línea recta formando un ángulo de 180º. Los orbitales p que quedan puros (sin hibridar) se ubican de forma perpendicular al eje de los orbitales sp híbridos y adoptando un ángulo de 90º entre sí. Estos orbitales p puros le permiten a un átomo dos dobles enlaces o un triple enlace.
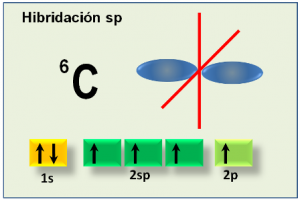
Si en determinada estructura un átomo de carbono cumple con lo anterior:
Entonces su hibridación será sp. Para los átomos de otros compuestos, como en el caso de los metales, la descripción de la geometría se complica debido a la existencia de orbitales d hasta f.
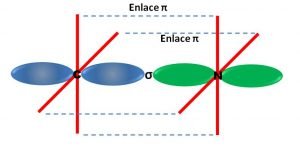
En este caso, como los orbitales híbridos se ubican de forma lineal formando un ángulo de 180º entre sí, los átomos enlazados formaran también una estructura lineal. Este hecho se puede ilustrar con la siguiente imagen, en la cual podemos observar la estructura adoptada por el ion cianuro.
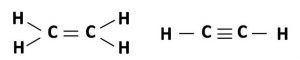
El Acetileno
Veamos el caso del acetileno, C2H2. Este alquino posee dos átomos de carbono con hibridación sp enlazados entre sí por medio de un triple enlace y a su vez, están unidos a átomos de hidrogeno por enlaces sencillos. Estas uniones se producen por el solapamiento de los orbitales híbridos de los dos átomos de carbono con los orbitales s de los átomos de hidrogeno, quedando de esta forma los átomos alineados. Adicionalmente, los átomos de carbono poseen orbitales p sin alterar los cuales quedan estructurados de forma perpendicular al eje de los orbitales sp híbridos, de esta forma pueden solaparse entre sí lateralmente constituyendo dos orbitales p, cuyos cuatro lobulos envuelven a los átomos de carbono, quedando unidos así por un triple enlace, uno fuerte s y dos débiles p. La estructura del acetileno se muestra en la siguiente imagen:

Esta hibridación es la típica en el átomo de carbono cuando esta enlazado a otros dos átomos, ya sea que este formando dos dobles enlaces o un triple enlace por un lado y un enlace simple por el otro. Estos conceptos son fundamentales para entender y poder trazar la estructura de muchos compuestos orgánicos

Referencias
Wikipedia. Hibridación
Wilipedia. Hibridación del carbono
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/10/hibridacion-de-orbitales-atomicos-hibridacion-tipo-sp
Muy buena recopilación @emiliomoron
Muchas gracias @yusvelasquez