El concepto de hibridación de orbitales fue introducido por el químico Linus Pauling en 1930 para poder explicar las formas características de enlace del átomo de carbono en los compuestos orgánicos. Esto con el propósito de explicar algunos vacios que deja la teoría del enlace de valencia, principalmente en cuanto al número de enlaces y la geometría de las moléculas.
Tomemos como ejemplo el átomo de carbono, como tiene una configuración electrónica:
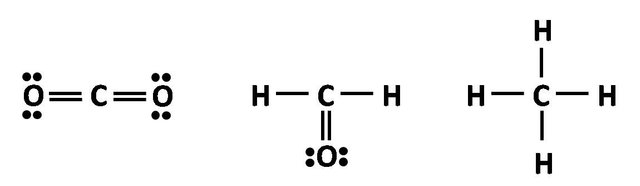
Uno esperaría que con solo dos electrones desapareados solo pudiera formar dos enlaces según la teoría del enlace de valencia, pero consideremos que como átomo central puede formar enlaces con dos, tres y hasta cuatro átomos; sino analicemos la estructura de Lewis para el CO2, el formaldehido (CH2O) y el metano (CH4):
Solo por nombrar algunos de los miles de compuestos de carbono que se conocen.
¿Entonces, que se requiere para que el carbono pueda formar hasta cuatro enlaces?
¡Pues nada más que tener cuatro electrones desapareados!
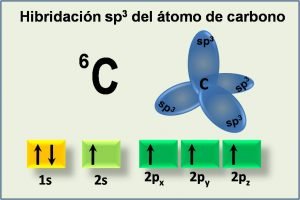
La forma más sencilla para que esto ocurra es que un electrón del orbital 2s pase al orbital que este vacío en 2p, es decir se pase a ocupar 2pz.
Pero, aunque esto puede explicar que pueda formar cuatro enlaces, se formarían tres enlaces iguales generados por los tres orbitales p, y uno diferente, generado por el orbital 2s. Pero si nos fijamos en la molécula de metano, los cuatro enlaces son iguales, formando una estructura tetraédrica espaciados cada enlace por un ángulo de aproximadamente 109,5º.
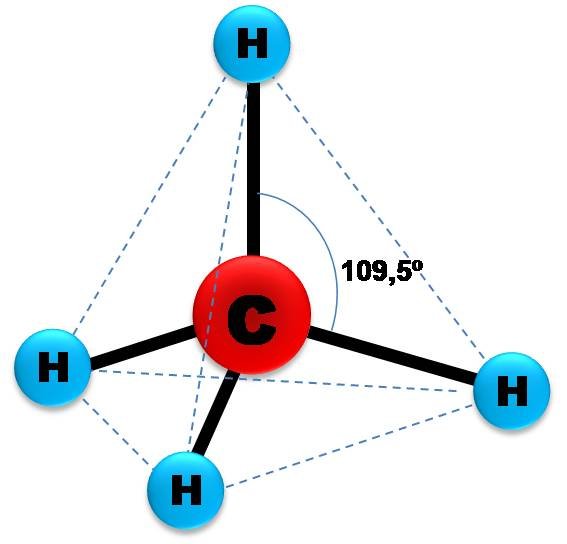 Geometría de la molécula de metano. Fuente: elaboración propia.
Geometría de la molécula de metano. Fuente: elaboración propia.
Es decir, que aún con lo expuesto en la TEV no se puede explicar las características observadas de forma experimental de esta molécula. Para poder explicar esta condición se recurre al proceso de hibridación.
En términos simples, la hibridación de orbitales es la combinación de las funciones de onda de individuales de dos orbitales s y p atómicos a fin de obtener orbitales con características intermedias con nuevas funciones de onda (orbitales híbridos). Estos resultan ser más direccionales que los orbitales s y p de forma individual, por lo que los enlaces que forman tienden a ser más estables.
Hibridación sp3
Para el caso de la molécula de metano, se dice que la hibridación es sp3. Como ya les había comentado, esto ocurre cuando se combina un orbital 2s y con los tres de 2p.
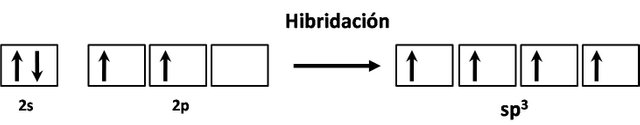
Con lo cual se forman cuatro regiones de densidad electrónica en torno al átomo de carbono. Es decir:
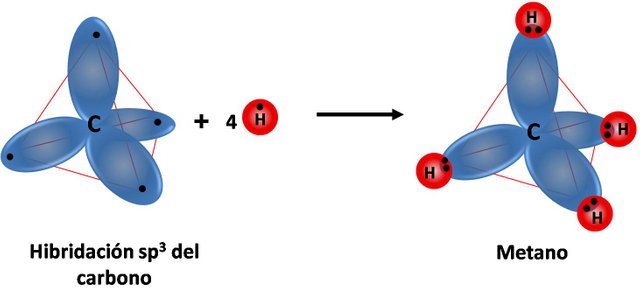 Fuente: elaboración propia.
Fuente: elaboración propia.
En la imagen se observa como los orbitales híbridos sp3 forman una estructura electrónica tetraédrica en torno al átomo de carbono. Y si se preguntan, ¿por qué 109,5º? Es porque este ángulo disminuye al mínimo la repulsión electrónica entre los cuatro átomos que se enlazan al carbono.
Así, la molécula de metano, adopta esta geometría tetraédrica, y se esperaría que en cualquier compuesto en el cual el carbono forme cuatro enlaces su hibridación sea sp3, y se adopte esta estructura.
Este concepto es fundamental para entender y poder trazar la estructura de muchos compuestos orgánicos, donde, como en el caso del átomo de carbono, los enlaces formados con el átomo central no conduzcan a una estructura plana. Bueno amigos, espero qe la información les sea de utilidad, hasta la próxima publicación donde cubriremos otros tipos de hibridación sp. ¡Hasta entonces!

Referencias:
Wikipedia. Hibridación
Lifeder.com.Hibridación qímica
Wikipedia. Hibridación del carbono
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/09/hibridacion-de-orbitales-atomicos





Finisimo @emiliomoron.
Muchas gracias amigo! me alegra que le gustara.
Tu explicación es muy fresca se entiende muy bien.
Gracias Breili. Me alegra que se pueda entender, saludos amiga.
Buen post, este fue mi tema favorito cuando cursé Química Inorgánica, saludos.
Gracias @aleestra. Es n tema interesante, saludos!