Entendiendo los mecanismos que alteran el pH de una solución: Medición mediante papel indicador y acotación por medio de indicadores.

Las mediciones de pH se han convertido en una herramienta analítica con bastantes aplicaciones en la actualidad, desde el tratamiento de agua en los ríos o lagos acidificados producto de las lluvias acidas, a causa de la contaminación al ambiente, hasta el control de alimentos y cosméticos que ameritan un pH específico. Las soluciones búfer, o amortiguadoras son capaces de oponerse al cambio de pH cuando se les adicionan pequeñas cantidades de ácidos o bases fuertes; mecanismo de gran importancia en la naturaleza, que en el caso del ser humano, es capaz de mantener la sangre con un pH estable de 7,4. Se realizaron estudios experimentales acerca de las técnicas para medir el pH de una forma apropiada y lo más exacta posible, se utilizó papel indicador marca, y algunos indicadores para acotar el valor de pH de distintas disoluciones de HCl, soluciones amortiguadoras con diferentes concentraciones de HCl, y varias sale, confirmándose en algunas de ellas la hidrolisis de sus iones. El contexto general de este post es determinar el pH de distintas soluciones, utilizando un papel indicador de pH, y utilizando la técnica de acotación con indicadores, para de esta forma entender todo el basamento teórico que involucra la medida y cálculo de tan importante concepto.
Base Teórica
Se puede decir que un ácido es toda aquella sustancia que sea capaz de donar un ion de hidrogeno en solución, formando una especia denominada hidronio (H3O+), mientras que la base es una especie capaz de aceptar estos iones.
Sin embargo, no todos los ácidos donan sus protones en la misma magnitud, los ácidos fuertes son aquellos que donan casi en su totalidad todos sus protones en agua, siendo la parte no disociada de éste despreciable. Se denomina ácido débil cuando esta disociación no se da por completo, es por ello que estos ácidos tienen un Ka asociado (constante que mida la capacidad de ionización de un ácido). Todo esto sucede análogamente para las bases.
Este tipo de constantes, se aplican para los ácidos y bases débiles, y viene dada matemáticamente de la siguiente forma; Siendo HA un ácido débil:
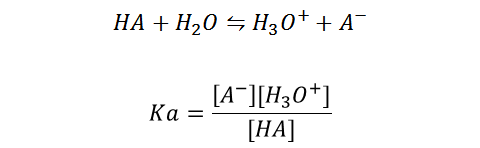
En el caso de las bases sucede de forma similar, siendo RNH2 una base débil en medio acuoso:
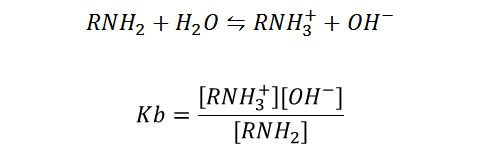
Constantes determinadas experimentalmente que permiten realizar los cálculos correspondientes en las disoluciones y/o reacciones ácido-base.
La concentración molar de H3O+ en una disolución acuosa es por lo común muy pequeña. En consecuencia, y por comodidad, H3O+ se expresa habitualmente en términos del pH, que es el logaritmo negativo de base 10 de la concentración del mismo. También existe una escala llamada pOH, donde se calcula el menos logaritmo en base 10 a la concentración de OH-. En una solución la suma de pOH y pH debe ser 14.
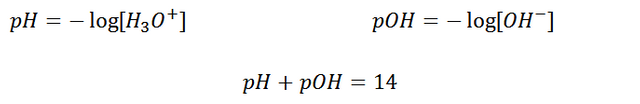
El agua posee la capacidad de comportarse como ácido en presencia de bases y como base en presencia de ácidos, por eso es denominada un compuesto anfótero. Es importante destacar la autoionización del agua:
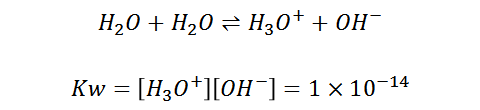
Calculando su pH a 25°C se obtiene un pH=7, el cual es considerado en la escala como un valor neutro.
Existen algunas soluciones llamadas búfer, o soluciones amortiguadoras las cuales están conformadas por un ácido o base débil y su sal correspondiente. Estas soluciones tienen la característica de ser capaces de regular el pH y resistirse a los cambios de éste cuando se les adicionan pequeñas cantidades de un ácido o base fuerte.
Otra forma de expresar la fuerza acida o fuerza básica se puede hacer mediante el pKb o pKa, las cuales son constantes que representan el menos logaritmo de una constante Ka o Kb para un compuesto específico.

Así pues, se podría calcular el pH de una solución amortiguadora, utilizando la ecuación de Henderson-Hasselbalch. La cual es muy útil pero no puede ser utilizada con soluciones muy diluidas ya que las aproximaciones que se hacen, representarían un gran error.

Para poder acotar el pH de una solución, es conveniente utilizar un indicador ácido-base, los cuales son ácidos o bases organizas débiles de estructura compleja. Su principal característica es que en sus formas ionizadas y no ionizadas presentan colores diferentes.
Entonces se podría determinar con ellos si alguna solución es acida o básica. Los indicadores también tienen una constante asociada.
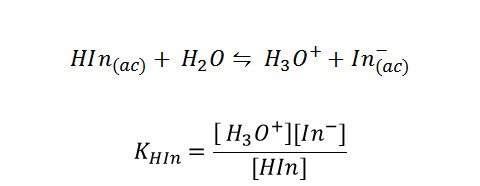
Cada uno de ellos tiene un rango de viraje en el cual los colores tanto de su forma básica como de su forma acida, se mezclan creando un color intermedio, y permitiendo acotar el pH en este rango. De lo contrario si no se produce este color intermedio, es necesario añadir otro indicador apropiado y así poder estimar un intervalo.
Cálculo del pH de las soluciones a utilizar:
Mediante las ecuaciones y propiedades ante expuestas se procede a calcular el pH teórico de las soluciones que fueron utilizadas en esta práctica.
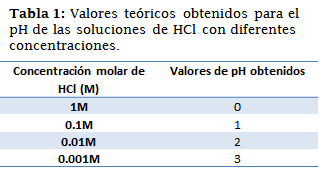
Inicialmente se necesitará el pH correspondiente a las soluciones de ácido clorhídrico (HCl) con diferentes concentraciones.
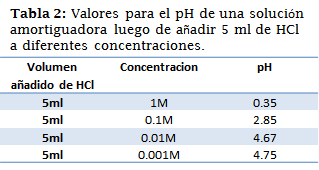
También se amerita el pH de las soluciones de 5ml del búfer acético/acetato de sodio de concentraciones 0.1M/0.1M luego de añadir 5ml de cada una de las soluciones anteriores de HCl.
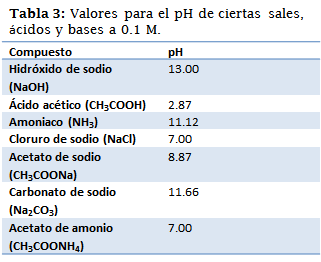
Para las practicas siguientes es importante conocer el pH de algunas sales, ácidos y bases de concentración 0.1 M en medio acuoso.
Lista de indicadores utilizados
Para realizar los experimentos antes mencionados se utilizaron los siguientes indicadores ácido-base.
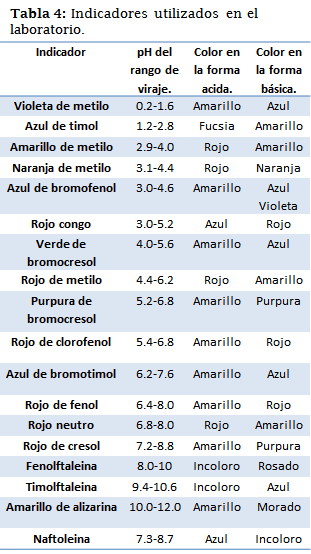
A continuación, se presentan algunos experimentos que pueden ser realizados en el laboratorio, con el objetivo de comprobar experimentalmente los aspectos teóricos que han sido descritos.
1. Medición del pH de soluciones de HCl.
Procedimiento:
Se midió inicialmente el pH soluciones de HCl de concentraciones 1M, 0.1M, 0.01M y 0.001M con el papel indicador agregando una pequeña gota de la solución a éste. Luego se acotó el pH mediante el uso de los indicadores apropiados para ello, en cada solución se usaron 2 pruebas con indicador.
Resultados:
Luego de hacer las mediciones de pH tanto por la técnica del papel indicador como con los indicadores líquidos se comprobó experimentalmente la acidez de cada una de las muestras.
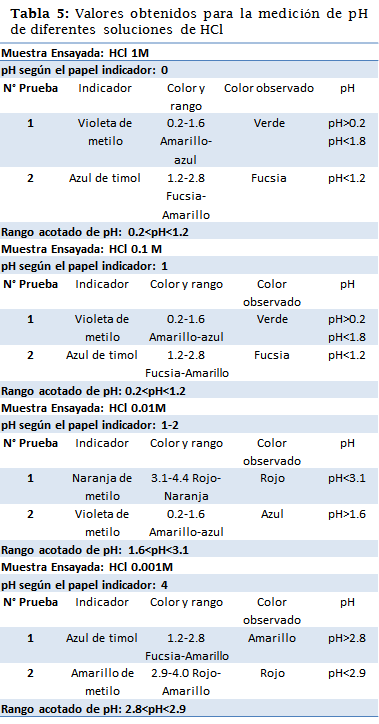
Es evidente que el papel indicador siempre da un resultado no muy exacto, con un intervalo de viraje de una unidad, sin embargo, se logró acotar cada pH con los indicadores ácido-base. En el caso de la solución HCl 1M, la cota resulto ser mayor a 0.2, lo que contradice los cálculos teóricos, es necesario resalar que esto puede suceder debido a algún error en la preparación de la solución, o referente al indicador, sin embargo 0.2 es un valor muy cercano a 0. Sucedió de forma similar en la solución de HCl 0.001M, en la cual teóricamente el pH es de 3, sin embargo, la cota no fue exacta, pero sí bastante cerca, se le atribuyen los mismos errores. En las otras dos soluciones (HCl 0.1 y 0.01 M) la cota fue satisfactoria.
2. Medición del pH a soluciones amortiguadoras, tampón o búfer.
Procedimiento:
Se añadió 5ml de cada una de las 4 disoluciones de HCl obtenidas en la experiencia 1, a 4 tubos de ensayo, a cada tubo se le añadió 5 ml de solución búfer de ácido acético/acetato de sodio de concentraciones 0.1M/0.1M (buffer de pH=4.76). Se midió el pH de las 4 soluciones obtenidas mediante el papel indicador y la acotación por indicadores. Se realizó el mismo procedimiento para estimar el pH del búfer y del búfer.
Resultados:
En la siguiente experiencia se comprobó la eficacia de una solución amortiguadora ante la perturbación ocasionada al añadir varias concentraciones de un ácido fuerte, HCl.

El buffer estudiado era de un pH =4.76, este valor fue comprobado, sin embargo, el papel indicador no fue suficiente para asegurarse de ello, las cotas mediante los indicadores, nuevamente afirmaron la veracidad del pH calculado teóricamente, ambas técnicas en conjunto fueron satisfactorias.
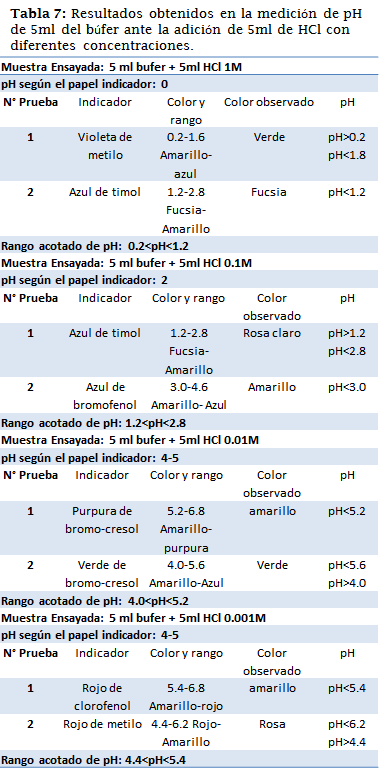
Los resultados obtenidos mantienen coherencia con los cálculos teóricos realizados anteriormente, una vez más el papel indicador fue una herramienta que acoto el pH en números enteros, pero en la mayoría de los casos estos rangos se confirmaron y/o redujeron con el uso de los indicadores. Una excepción de esto es el resultado del papel indicador en la muestra 1, la cual sugería como resultado un pH=0, los indicadores resultaron ser más exactos convirtiendo este valor en un rango más aceptable (0.2<pH<1.2).
3. Medición del pH a diversas soluciones acuosas.
Procedimiento:
Se determinó el pH usando el método anterior (medición por papel indicador y acotación con indicadores ácido-base) soluciones 0.1M de diferentes compuestos (ácidos, bases y sales)
Resultados:
La siguiente práctica, demostró la acidez o basicidad de algunas sales, también el pH de ácidos y bases (fuertes y débiles). A continuación, se muestran los valores obtenidos siguiendo el mismo método.
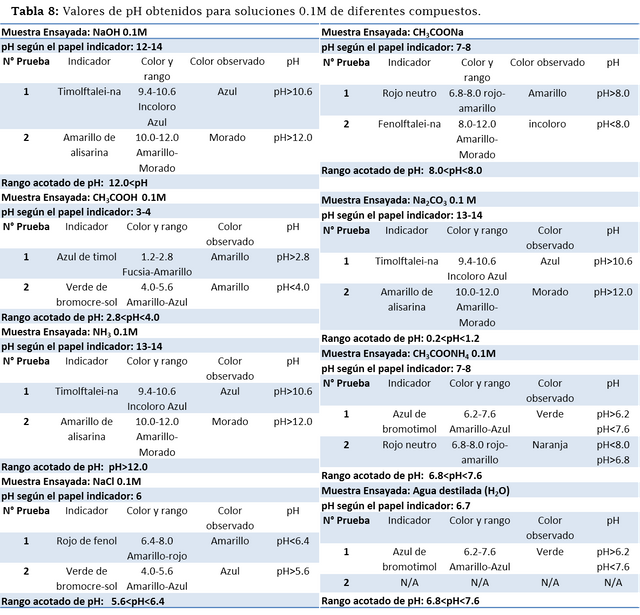
Algunos resultados no fueron similares a los valores teóricos obtenidos anteriormente, el amoniaco (NH4) resulto ser (según el indicador amarillo de alizarina) una solución con un pH mayor a 12, sin embargo, teóricamente no debería alcanzar este valor; la solución de cloruro de sodio (NaCl) implico un pH bastante ácido, el cual no es característico de esta solución (debería tener un pH=7). En el caso del agua solo se utilizó un indicador debido a que al añadir otros indicadores el resultado era totalmente incongruente con el resultado obtenido con el azul de bromotimol, y con los cálculos teóricos, por esta razón se decidió utilizar solo ese, que además era coherente con el resultado del papel indicador.
Uno de los mejores resultados fue el del acetato de sodio (CH3COONa) el cual fue acotado en un intervalo de (8.0;8.0), esto quiere decir que el valor real de pH es muy cercano al 8, este resultado si bien fue bastante preciso, no fue exacto, ya que el valor teórico es de 8.87. Con respecto a los otros compuestos, el resultado fue bastante cercano al real y tanto el papel indicador como los indicadores líquidos satisfacen el valor de pH de cada uno de ellos. No obstante, es importante mencionar que una fuente de error en esta apreciación pudieron ser los mismos indicadores químicos en conjunto con la percepción del color del ojo humano.
Conclusión General
Luego de comparar el pH estimado por el papel indicador y ciertos indicadores, se puede decir que el papel indicador por si solo siempre dará un rango de pH mayor a uno (dependiendo de la escala de la compañía que lo fabrique). Luego con el uso de uno o dos indicadores se podría acotar fácilmente este valor en un rango notablemente reducido, así pues, en conjunto estas dos herramientas son bastante confiables.
Se observó que el pH es inversamente proporcional a la concentración de un ácido (en este caso HCl) y directamente proporcional a la concentración de alguna base (por ejemplo: NaOH).
La solución búfer disponible en el laboratorio fue capaz de amortiguar considerablemente el pH de las disoluciones de ácido más diluidas, lo cual resalta su importancia para la naturaleza.
En el caso de las sales, fue notable los distintos pH que pueden obtener en medio acuso, productos de la capacidad de hidrolisis de alguno de sus iones, algunas bastante acidas y otras básicas.
En general algunos errores pudieron haberse presentado, desde la preparación de las soluciones (error sistemático o aleatorio), lo cual podría afectar la concentración de las especies y por ende el pH. Algunos indicadores también pudieron tener fallas asociadas a su preparación, cabe destacar también el error humano correspondiente a su percepción de los colores, ya que en algunos casos ésta puede tornarse muy ambigua y poco objetiva.
En general la practica mostro las nociones fundamentales acerca del pH y de los compuestos que podrían o no afectarlo, además de técnicas analíticas y efectivas para su medición.
Dato Curioso
Estoy seguro que muchos ustedes han oído hablar de la fenolftaleína. La fenolftaleína es un indicador químico que se utiliza para identificar soluciones básicas, ya que tiende a permanecer incoloro cuando está en presencia de soluciones ácidas, frecuentemente es utilizada en la ciencia forense para determinar presencia de sangre en las escenas del crimen. Comúnmente visto en las diferentes variaciones de CSI.
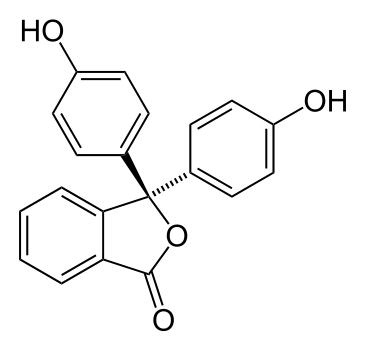

La fenolftaleína utilizada en este caso es la molécula de fenolftaleína reducida (adición de 2 electrones) mediante un proceso de reducción utilizando zinc metálico y calor. Luego de ello se almacena una solución alcalina cuya coloración es incolora ya que la fenolftaleína reducida no presenta la coloración púrpura original.
Cuando está solución básica entra en contacto con la sangre y luego de ser roseado el peróxido de hidrógeno, se produce una reacción química en la cual el peróxido de hidrogeno es reducido por la molécula de hemoglobina (presente en los eritrocitos de la sangre y responsable del color rojo), la cual utiliza los electrones de la fenolftaleína reducida para llevar a cabo este proceso (oxidación de la fenolftaleína). Al estar ocurriendo todo esto en medio básico, la fenolftaleína luego de ser oxidada, inmediatamente a porta el color purpura a la solución, arrojando como resultado positivo a la presencia de sangre en la muestra. Este test es llamado Prueba de Kastle-Meyer
Espero que este artículo haya sido de su agrado, personalmente considero este tipo de fenómenos, unos de los más impresionantes e interesantes. Es importante conocer cada día más el mundo que nos rodea y las manifestaciones del mismo que, en gran medida, lograran sorprendernos.
Seguimos a la espera de los grandes desarrollos que nos traerá el futuro, tú decides si ser espectador o realizador. Todos los días podemos aprender algo nuevo.
Gracias por leer.
Referencias:
Todas las imágenes de mi autoría, fueron editadas y procesadas utilizando el programa PowerPoint 2016.
- Theodore Brown, Eugene LeMay, Bruce Bursten, Julia Burdge, (2004), Quimica. La ciencia central. (9° Edición). Pearson Educación, S.A., Capitulo 04.
Douglas Skoog, Donald West y James Holler (2006) Fundamentos de Química Analítica (4ta Edición) Editorial Reverté.
CRC HandBook of Chemistry and Physics, 86th Edition, CRC Press 2005
Arthur I. Vogel et al. (1989) Textbook of Quantitative Chemical Analysis, 5th edition, Longman Scientific & Technical.

Posted from my blog with SteemPress : http://aleestra.vornix.blog/entendiendo-los-mecanismos-que-alteran-el-ph-de-una-solucion-medicion-mediante-papel-indicador-y-acotacion-por-medio-de-indicadores/
La medición de pH siempre será un paso importante en cualquier ensayo químico, así como es importante conocer las desviaciones de los métodos disponibles para su medición.
Asi es @emiliomoron , personalmente considero que la medición con indicadores es mucho mas cualitativa e idea para la enseñanza. Actualmente los dispositivos más avanzados trabajan con potenciometría y son bastante interesantes. Muchas gracias por comentar, saludos.
Este articulo fue seleccionado por el equipo de @bebeth
Hola @aleestra, ¡Gracias por este contenido de Calidad!
Recibe nuestro Sello de Genialidad, asi como nuestro voto y el de nuestra patrocinadora @beanz en reconocimiento.
Afrodita-A Tecnologia de optimizacion de VP y Votos desarrollada por @nnnarvaez
Muchas gracias! Excelente iniciativa, saludos.