[simple review] 암의 치료에서 면역 요법이 성공하려면?
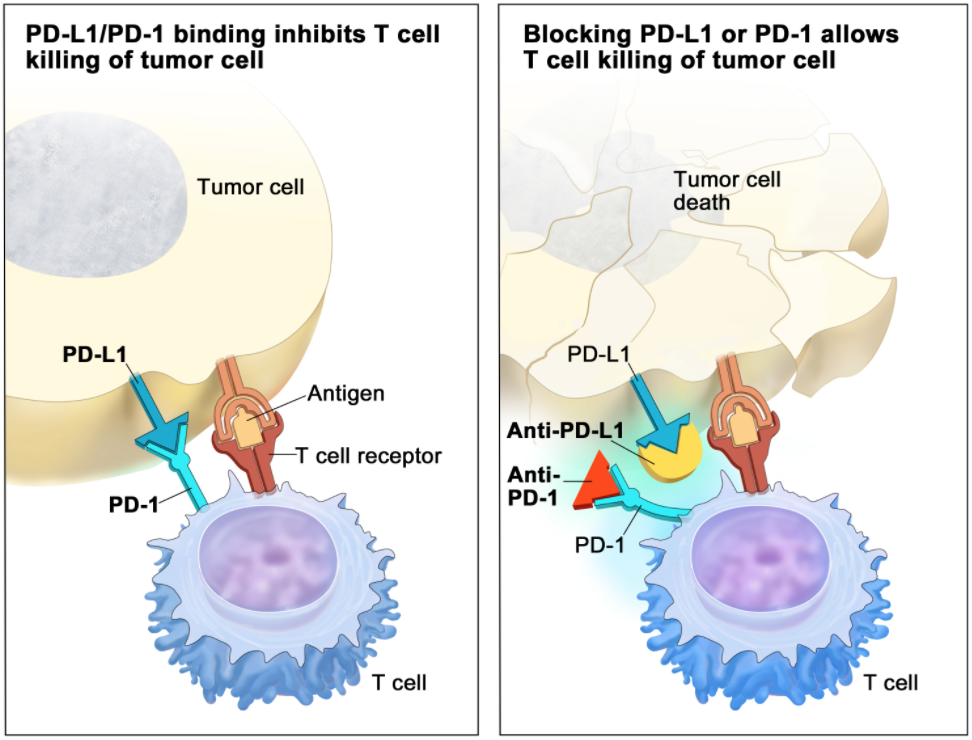
진행된 암의 치료에서 면역 요법의 성공이 점차 증가하고 있음에도 불구하고, 암 환자의 극소수만이 이러한 면역 치료에서 임상적인 치료효과를 보고있는 것이 현재의 실정이다.
최근의 바이오 마커 연구는 anti PD-1 monoclonal antibody, anti-CTLA4 monoclonal antibody 및 암 백신으로 치료를 받고있는 대부분의 환자가 초기 치료시점에서 볼때 이미 병변부위에 T 세포 염증성 종양의 미세 환경을 가지고 있는 상태에서 만이 치료효과를 보인다는 것이다.
anti PD-1 mAb를 투여받은 흑색 종 환자의 치료 후 생검(조직검사) 결과로 보면 CD8 + T 세포가 종양 미세 환경 속으로 깊게 침투되어 그 수가 증가되는 것을 보여줬다.
전임상 데이타에서 보여주는 이러한 증거들은 결국 checkpoint 억제제들의 치료효과는 암세포속에 이미 존재하고 있었던 CD8+ T cells의 활성화를 통하여 나타난다는 것이다.
그러나 적응성 면역 세포 침윤(adaptive immune cell infiltration)이 완전히 없는 암 환자의 경우에는 T 세포가 들어갈 수 있는 환경으로 만들어 주어야만 현재의 면역 요법에 반응 할 수있는 새로운 치료과정이 필요할 수 있다. (왜? T-cell이 있어야만 anti PD-1 mAb이 치료효과를 나타내기에...)
이와 같이 T 세포가 없을때 혹은 배제 되었을때의 기본 메커니즘을 완전히 이해하는 것은 임상적으로 중요한 생물학적 질문이 되어버렸다.
실험실에서는 개별 환자에서 T 세포 염증성 종양 미세 환경 표현형(phenotype)의 존재 또는 부재를 설명 할 수있는 환자들 간의 이질성(inter-patient heterogeneity)의 3 가지 잠재성에 대하여 깊이있게 연구를 아래와 같이 해왔다.
- 종양 세포 수준에서의 신체적 차이(somatic differences at the level of the tumor cells)
- 숙주 수준에서의 생식선 다형성 차이(germline polymorphism differences at the level of the host)
- 장내 미생물 수준에서의 환경 차이(environmental differences at the level of the intestinal microbiota)
특정 종양 유전자 경로(specific oncogene pathways)의 활성화가 개인별 환자의 종양에서 면역반응 회피(immune exclusion)를 중재 할 수 있다는 가설을 시작으로, Cancer Genome Atlas (TCGA)의 266 종양 샘플의 전이성 흑색종 데이터를 활용하여 T 세포 염증 표현형을 나타내는 유전자 표지의 유무에 따라 분류 하였다.
이 같은 종양을 사용하여 exome sequencing과 pathway analysis를 수행하여 비 T 세포 염증 종양(non-T cell-inflamed tumors)의 48 %가 Wnt / β-catenin 경로의 활성화를 보였다.
β- 카테닌 경로의 활성화가 면역 회피가 인과 관계가 있는지를 확인하기 위해 conditional BrafV600E induction, PTEN deletion 및 / 또는 β- catenin의 stabilization와 쌍을 이루는 melanocyte-specific, tamoxifen-regulated Cre를 이용하여 자가 흰쥐 모델을 개발 하였다.
BrafV600E 및 PTEN deletion에 의해 유도 된 암세포에서는 T 세포 침윤(infiltrate)이 실제로 관찰 되었지만, 이 T 세포 침윤물(infiltrate)은 active β- catenin을 추가로 발현하는 암세포에서는 전혀 나타나지 않았다. 그러니까 active β- catenin이 있는 경우에는 T-cell infiltration은 일어나지 않았다는 것이다.
SIY antigen-reporter mouse (Rosa26-Lox-Stop-Lox-SIY)를 SIY-specific TCR transgenic T cells (2C T 세포)의 adoptive transfer와 함께 사용하여 T 세포가 배제되는 기전을 더 조사 하였다.
rafV600E / PTEN 마우스에서 전달 된 T 세포의 활발한 activation 및 암세포 축적이 관찰 되었지만, active β-catenin을 추가로 발현하는 종양을 갖는 마우스에서는 이러한 T 세포의 활성화 또는 암세포 축적이 관찰되지 않았다.
이 관찰은 β-catenin이 발현된 암세포에서 CD103 / CD8α 수지상 세포 (DCs)의 현저한 감소를 보여주는 두개의 암세포 타입에서 antigen-presenting cell의 별도의 다른 구획(영역)이 있다는 사실을 인지하게 되고 이에 대한 분석을 하게되는 계기가 되었다.
Flt3 ligand-derived DCs의 종양 내 주사를 이용하여 복원시키는 실험은 T 세포 침윤의 회복을 보여 주었다.
Batf3-lineage DCs의 recruiting에 실패한 메커니즘을 더 깊이 탐구하기 위해 두 종양 유전자형(two tumor genotypes)의 유전자 발현 프로파일링(gene expression profiling)을 chemokine에 초점을 맞추어 수행했다.
이 연구는 일반적인 보통의 BrafV600E / PTEN 종양 세포의 경우는 케모카인 CCL4를 분비 할 수 있는 반면, stabilized β-catenin을 추가로 발현하는 종양 세포에서는 CCL4 발현이 관찰되지 않았음을 보여 주었다.
이러한 발견은 마우스 모델 뿐만 아니라 active β-catenin signaling를 함유하거나 함유하지 않은 인간 흑색 종 세포주(human melanoma cell line)에서 유래 된 종양 세포주를 사용하여 확인되었다.
active β-catenin이 CCL4 유전자 발현을 억제하는 능력은 ChIP 분석으로 확인되었는데, CCL4 프로모터에 결합하는 것으로 확인 된 전사 억제 인자(transcriptional repressor) 인 ATF3의 유도로 맵핑되었다.
이 2 가지의 종양 유전자형(two tumor genotypes)을 이용하여 checkpoint 억제제에 대한 in vivo효능을 조사하기 위해, 마우스를 anti-CTLA4 와 anti-PD-L1 mAb의 조합으로 치료 하였다.
이 치료법은 BrafV600E / PTEN 마우스에서 종양 성장을 지연 시켰지만, active β-catenin을 추가로 발현하는 종양을 보유한 마우스에서는 치료 효과가 관찰되지 않았다.
checkpoint 억제제에 대한 반응성은 FLt3L induced DC의 직접 주입(direct injection)을 통해 회복되었으며 이런 결과로 종양 항원 특이적 T 세포(tumor antigen-specific T cells)를 활성화 하기위해 DC가 중요한 역할(rate-limiting role)을 한다는 것이 증명되었으며 결국 checkpoint 억제제에 대한 반응이 나타났다.
<그러니까 checkpoint 억제제가 반응성이 나타나지 않은 것은 DC가 없어서이고 DC를 넣어주면 T-cell의 활성화로 checkpoint 억제제가 약효를 보이게 된다.>
결과적으로;
종양 세포 내의 종양 발생 경로가 항 종양 면역 반응에 직접적으로 영향을 미칠 수 있다는 연구결과로 이 분야의 연구 방향과 새로운 표적 억제제의 임상 개발의 우선 순위에 영향을 미칠 가능성이 있다.
면역 체계로부터의 회피는 잘 알려진 현상이지만, 지금까지 항원 분비 변이에 대한 면역 매개 선택에 초점을 맞추어 왔으며, 잔류 항원에 대한 중간 친화도 TCR을 갖는 잔류 T 세포의 역할을 방해하는 면역 억제 기전의 상향 조절과 결합한다.
그러나, 이러한 기전은 항원을 발현하는 종양 세포를 포함하지만 그럼에도 불구하고 숙주 면역 반응(host immune response)와의 대화를 하는데 실패한 non-T cell-inflamed tumor microenvironment phenotype의 존재를 설명하지 못했다.
사실, 비 T 세포 염증 표현형(non-T cell-inflamed phenotype)은 사람 표본(human sample) 및 종양 유형의 스펙트럼 전반에 걸친 TCGA 데이터 분석에서 관찰되는 가장 일반적인 패턴이므로 면역 저항의 메커니즘(mechanism of immune resistance)에 대한 생물학적 이해가 무엇보다 중요하다.
Wnt / β-catenin 경로의 활성화가 흑색 종 이상의 추가 암에서의 면역 회피와 관련이 있을 수 있다.
예비 자료에 의하면 β-catenin pathway는 방광암(bladder cancer)과 두경부 암(head and neck cancer)에서 T 세포 배제(T cell exclusion)와 관련이 있음이 밝혀졌다.
PI3K / PTEN 경로도 조사 중이지만 지금까지 다소 모순 된 데이터가 있다.
트리플 네거티브 유방암 환자(triple negative breast cancer patients)의 샘플을 분석 한 결과, PTEN의 소실(loss of PTEN)은 종양 미세 환경(microenvironment) 내 T 세포의 존재와 관련이 있음이 나타났다.
그와는 대조적으로, 악성 흑색 종(malignant melanoma)에 대한 데이터는 반대를 나타낸다.
따라서 이 질문에 명확하게 대답하기 위해서는 암 유형별 역학 연구가 필요할 수 있다.
종양 유형의 전 범위에서 이들 및 기타 종양 유전자 경로에 대한 조사는 계속되어야 하고 연구에 있어 높은 우선 순위로서 확립되어야 한다.
면역회피에 의해 발생되는 종양의 메카니즘이 기계적으로 규명이 됨으로써 이 경로를 차단하는 약리학적 접근법은 anti PD-1과 같은 면역 요법(immunotherapeutics)과 함께 조합 연구(combination study)가 진행 되어야 할 것이다.
내성 면역 요법(resistance immunotherapy)과 병용 요법(combination therapy)의 분자 기작을 확인하는 양방향 반복 번역 연구 프로그램(translational research program)이 궁극적으로 암 환자의 대다수를 포괄하는 임상적 영향의 확대로 이어질 것으로 예상되는데 그것이 얼마나 빨리 이루어질지는 좀 더 두고 봐야 할 것이다. ^^*