les métaux dans la vie
Généralités: c'est quoi un métal!!
Corps opaques, pesants, qui se trouvent, dans la nature, associés à des substances terreuses ou entre eux, et qui constituent alors des composés connus sous le nom de mines. Les Grecs et les Romains ne connaissaient que sept métaux, l'or, l'argent, le fer, le cuivre, le plomb, l'étain et le mercure.
Aujourd'hui la chimie, qui compte 49 métaux, ne peut les définir que d'une manière très générale, en disant que ce sont des corps simples, liquides ou solides, attaquables par l'oxygène ou par les acides.
.jpg)

1-La Structure des métaux:
Les métaux n'ont pas habituellement une structure homogéne méme lorsqu'ils sont trés purs; un examen microscopique montre qu'ils sont formés par une assemblage de petits cristaux(micro cristaux) 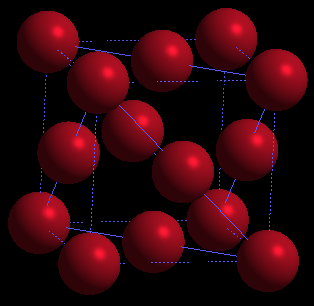
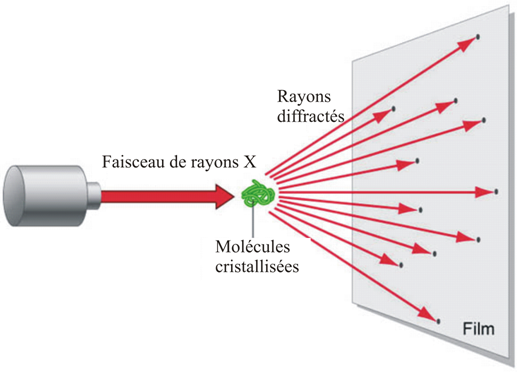
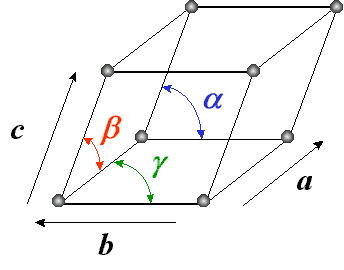
Une étude aux rayons X montre que chaque cristal est formé par un arrangement réguliér et ordonné d'atomes identiques. chaque atome peut libérer un ou plusieurs électrons (c'est la propriété essentiel des métaux).
2-Oxydation des métaux:

il s'agit la de la réaction essentielle puisque elle résulte de leur définition.
a)-Oxydation par l'oxygéne:
Tout les métaux que nous étudierons sont attaqués par l'oxygéne. dans l'oxygéne pur, en particulier, la plupart d'entre eux peuvent bruler lorsqu'ils sont portés au rouge.
Nous avon observé de nombreux exemples: combustions du sodium, du fer, du magnésium.....
La couleur de la flamme varie selon la nature du metal

b-Oxydation par le chlore:
Tout les métaux sont attaqués par le chlore a température plus ou moins élevée, lorsque cet oxydant est en excés, le métal céde le maximum d'électrons et se transforme en l'ion le plus positif.
c- Oxydation par le soufre:
les métaux sont attaqués par le soufre et transformés en sulfures, c'est d'ailleurs sous la forme de sulfure que beaucoup d'entre eux existent a l'état naturel (sulfure de fer, sulfure de zinc, sulfure de plomb, sulfure de mercure....)

.jpg)
.jpg)
LES METAUX SONT DES ELEMENTS ELECTROPOSITIFS? ILS S'OXYDENT FACILEMENT
3-Propriétés physique dés métaux:
a)Couleur:
tous les métau ont un grand pouvoir reflecteur de la lumiére. lorsque la surface n'est pas oxydée; 'l'eclat métallique' est caractéristique; la couleur peut étre variée (rouge pour le cuivre, jaune pour l'or, gris-blanc pour l'argent, gris-bleuté pour le zinc.....)
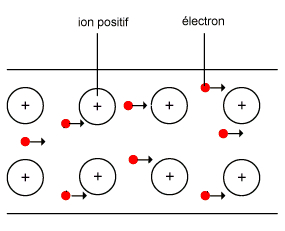
b) Conductibilités thermique et électrique:
Les métaux sont de bons conducteurs de la chaleur et de l'electricité grave aux electrons libres de leur réseau cristallin.
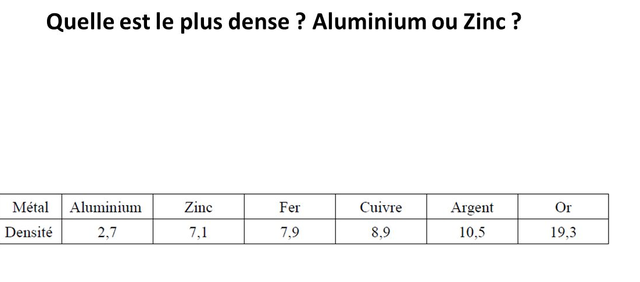
c) Densité:
Les métaux légers comme l'aluminium et le magnésium ont une densité inférieure a 3; exceptionnellement, ils peuvent étre moins denses que l'eau (sodium ou potassium)
Les métaux lourds ont une densité supérieure a 10 ou voisine de 10 comme le platine, plomb, mercure....
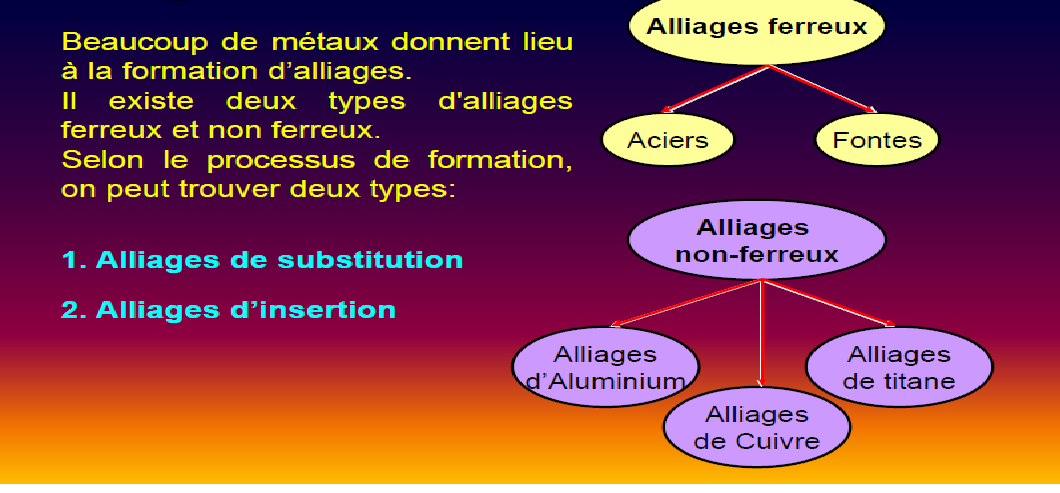
4-Les Alliages des métaux:
.jpg)






En tout, on compte seulement six métaux utilisés de manière très fréquente :
Le fer, de symbole atomique Fe.
Le cuivre, de symbole atomique Cu.
Le zinc, de symbole atomique Zn.
L'aluminium, de symbole atomique Al.
L'or, de symbole atomique Au.
L'argent, de symbole atomique Ag.
#life
Alice Walker:The most common way people give up their power is by thinking they don’t have any.nice quote :)