[화학] 배터리 수명연장을 위한 팁 - 배터리와 화학 (1)
안녕하세요! aksen입니다
오늘은 배터리(다른 말로는 전지라고도 하죠) 에 대해서 다뤄보고자 합니다
"핸드폰 배터리가 벌써 다 닳았네?? 가득 충전시킨지 얼마 안됬는데..."
다들 한 번씩 경험해 보신 일이죠? 새로 산 직후에는 조금만 충전시켜도 오래동안 쓸 수 있었는데 사용하다 보면 배터리가 금방금방 닳곤 합니다.
이유는 바로 배터리의 용량이 줄어들어서인데요. 그럼 왜 배터리의 용량이 닳는지, 어떻게 하면 방지할 수 있는지 알아보도록 합시다.
1. 전지의 시초
전지의 작동원리를 알려면 가장 처음 만들어진 전지가 무엇인지 알아보아야겠죠?
전지를 처음 발명한 사람은 볼타(Volta, 1745~1827)입니다. 그의 업적을 기려 전압의 단위를 볼트로 쓰고 있죠.
그가 발명한 전지의 이름은 볼타전지 입니다. 생김새는 다음과 같죠.
볼타는 구리와 아연을 겹겹이 쌓고, 그 사이사이에 황산을 적신 헝겁을 끼워넣었습니다. 그리고 이 금속탑의 가장 위와 아래를 연결했죠.
그럼 이와 같은 금속탑이 왜 전지가 될 수 있을까요? 다음으론 전지의 원리를 알아보도록 합시다.
2. 전지의 원리
전지는 기본적으로 산화환원반응의 결과입니다. 먼저 산화와 환원이 무엇인지 봅시다.
산화: 전자를 잃는 반응
환원: 전자를 얻는 반응
자, 감이 오시나요? 전류는 결국 전자의 흐름이죠. 산화반응을 하는 전극과 환원반응을 하는 전극을 전선으로 이어준다면 산화전극이 잃은 전자가 나와서, 전선을 타고 흘러서, 환원전극으로 들어가게 되는거죠!
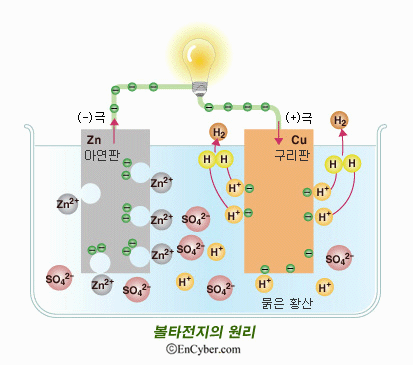
그럼 이 원리를 볼타 전지에 적용시켜 볼까요?
우선 볼타전지에서 아연판에선 산화반응이, 구리판에선 환원반응이 일어납니다. 황산을 적신 헝겁은 금속판 사이에서 전류가 흐를수 있도록 전해질의 역할을 해주죠.
따라서 아연판이 잃어버린 전자가 구리판으로 들어가게 되고, 이러한 움직임이 전류를 만들어 내는겁니다.
위 반응을 식으로 살펴볼까요?
산화반응:
환원반응:
전체반응:
어라? 산화반응은 그렇다쳐도 환원반응이 뭔가 이상하네요? 왜 구리전극에서 구리가 나오는 것이 아니라 수소가 나왔을까요?
그 이유는 구리 이온이 없기 때문입니다. 구리가 석출되려면 구리 이온이 전자를 받아서 구리가 되어야 하는데 볼타전지에는 어디에도 구리이온이 없죠. 만약 전해질에 구리이온이 있었더라면 환원반응은 다음과 같이 바뀌었을 것입니다.
자, 지금까지 볼타전지에 대해 알아보았는데요. 다음 시간에 이어서 우리가 사용하고 있는 전지의 종류, 그리고 최종 목표인 배터리 수명연장을 위한 방법을 알려드리도록 하겠습니다!
다음 글 링크 https://busy.org/@aksen/2
5월 다시 파이팅해요!
호출에 감사드립니다!
물리때 배운게 살짝 기억나네요 ㅋㅋ
리튬 이온전지도 비슷한 원리겠죠? +-전극판과 전해질만 다를것같은데
잘보고 갑니다
맞아요 ㅋㅋ 안그래도 뒷편을 지금 쓰고있어요 ㅎㅎ 오늘 내에 올릴 예정이니 많은 관심 부탁드려요 ㅋㅋㅋ
안녕하세요 뉴비입니다. 앞으로 잘 부탁드려요^^
저도 3일된 뉴비랍니다! 잘부탁드려요