Alltagsfrage #3: Warum tauen Eis und Schnee durch Salz auf?
Eis und Schnee aber die Wege bleiben frei, warum?

Bei uns hat es heute wieder geschneit, aber trotz 4 cm Neuschnee bleiben die Wege schnee- und eisfrei. Woran das liegt weiß vermutlich jeder, es wurde Salz gestreut. Aber warum bleibt der Schnee nicht liegen wenn Salz gestreut wurde? Oder löst sich gar auf wenn Salz darüber gestreut wird?
Das Phänomen wird als Gefrierpunktserniedrigung bezeichnet, also die Herabsenkung des Gefrier- bzw. Schmelzpunktes von Wasser durch Zugabe anderer Stoffe. Reine Lösungsmittel, wie (Süß-)Wasser, haben stets einen höheren Gefrierpunkt als Lösungen, wie Salzwasser. So kann ein Süßwassersee im Winter bei 0 °C schnell zufrieren, das Polarmeer hingegen bildet erst bei etwa -1,9 °C Eis. Das Eis, das auf dem Polarmeer schwimmt, ist allerdings gefrorenes Süßwasser, kein Salzwasser! Bei der Kristallisation, also dem Gefrieren von Wasser zu Eis, bilden sich keine Mischkristalle aus Wasser und Salz sondern ein reiner Eiskristall aus Wasser.
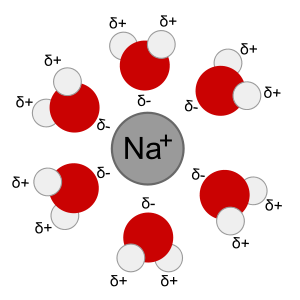
Dieser Effekt findet genauso statt, wenn Salz auf festes Eis gestreut wird. Auf dem festen Eis befindet sich immer eine sehr dünne Schicht von flüssigem Wasser, der Chemiker spricht hier von einem dynamischen Gleichgewicht. Eine gesättigte Mischung aus Kochsalz und Wasser hat einen Gefrierpunkt von etwa -21 °C (nicht zu verwechseln mit dem oben angesprochenen Salzwasser: Salzwasser enthält etwa 35 g Salz pro Liter, eine gesättigte Kochsalzlösung enthält etwa 360 g(!!!) pro Liter, daher ist der Gefrierpunkt wesentlich niedriger!). Gibt man nun Salz auf das Eis löst sich ein Teil in dem Flüssigkeitsfilm, es bilden sich Hydrathüllen aus Wasser um das Salz, daher steht das Wasser nicht mehr dem Gleichgewicht zur Verfügung. Neues Eis schmilzt um den dünnen Flüssigkeitsfilm aufrechtzuerhalten, in diesem löst sich erneut das Salz usw. Das gesamte Eis oder der Schnee wird so allmählich geschmolzen. Zugefrorene Straßen und Wege können so geräumt werden und bleiben, solange genug Salz vorhanden ist, auch eisfrei.
Dieses Prinzip findet auch bei Kältemischungen Anwendung, bereits die Römer wussten das sich durch Vermischen von Eis und Salz tiefere Temperaturen erreichen lassen. Und auch Napoleons Streitkräfte konnten sich so während des Feldzuges in Ägypten mitten in der Wüste eiskalte Getränke zubereiten, ohne Kühlschrank!
Hi my name is Jerome. I am giving away 0.500 SBD for signing up to this ICO
After you have completed you will receive your reward