Los sorprendentes equilibrios de fases del agua.

Fuente: pixabay.com
¿Alguna vez escuchaste hablar de que puede existir hielo a más de 100 ºC? ¿O de que el agua puede permanecer en estado líquido por debajo de 0 ºC?
Antes de explicar la respuesta a las preguntas iníciales debemos comenzar por entender algunos conceptos claves. Comencemos con el diagrama de fases del agua.
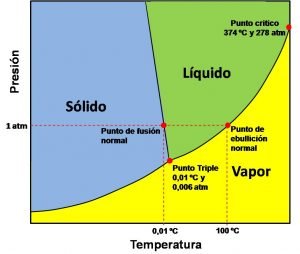
Fuente: elaborada por el autor
Las regiones o zonas abiertas del diagrama corresponden a estados de una sola fase, le damos el nombre de fase a la porción del sistema que es homogénea en composición y físicamente diferenciable, para el sistema mostrado del agua, pueden coexistir tres fases: agua líquida, hielo y vapor. Como podemos observar a bajas temperaturas y por debajo de 2 atmosferas de presión solo hay una fase en el sistema, el hielo, a temperaturas por encima de los 0 ºC y presiones moderadas el agua permanece en estado líquido, y a altas temperaturas o bajas presiones la fase posible es el vapor.
Cada fase está separada de las otras por una línea limite conocida como línea de equilibrio bifásico, es decir donde pueden coexistir simultáneamente dos fases, como por ejemplo, en una olla con agua hirviendo están presentes agua en estado líquido y su vapor, o en un vaso con hielo están en equilibrio los estados líquido y sólido. Como vemos, es posible que existan estos equilibrios en un rango amplio de temperatura y presión, es decir, el agua no solamente puede entrar en ebullición a 100 ºC, puede hacerlo a una menor temperatura si la presión es más baja, o viceversa. Por ello, en una ciudad ubicada a una gran altitud, por ejemplo La Paz en Bolivia (ubicada a casi 4000 msnm), donde la presión atmosférica se reduce a 487 mmHg, el agua herviría a aproximadamente 89 ºC, en lugar de aproximadamente 100 ºC como lo hace a nivel del mar donde la presión atmosférica es cercana a 760 mmHg.
También se observan dos puntos especiales, uno se conoce como el punto triple, en que habrán notado que pueden existir las tres fases en equilibrio al mismo tiempo, para el agua este punto se consigue a 0,01 ºC y 0,006 atmósferas o 4,58 mmHg, recordemos que la presión atmosférica (1 atm) equivale a 750 mmHg, por lo que se consigue a una presión bastante baja. El otro punto es el llamado punto crítico, donde se produce el final de la división clara entre la fase vapor y líquido, en condiciones más allá de ese punto se pierden las propiedades de ambos fluidos, y se obtiene una mezcla de ambos.
Pero volvamos a las preguntas iníciales. ¿Es posible que exista hielo a más de 100 ºC? de hecho en la literatura y en la web abunda el diagrama de fases del agua a presiones moderadas, pero este no está completo, a presiones elevadas se han observado modificaciones en la fase sólida, y el sistema agua se vuelve más complejo, en la siguiente figura se observa una representación del diagrama de fases para el agua que incluye algunas de las regiones a altas presiones.
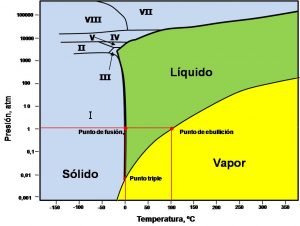
Fuente: imagen edtada por el autor imagen original
Entonces, según este segundo diagrama, para obtener hielo a más de 100 ºC solo se debe calentar agua a una presión lo suficientemente alta como para mantenerla en estado líquido a 100 ºC, digamos 100 atmosferas, y luego seguir incrementando la presión sobre el líquido, por encima de las 20.000 atmosferas comenzará la cristalización del agua en hielo VII. No es imposible, aunque si complicado y costoso.
Mencione que la fase Ic del hielo es metaestable, ¿sabes lo qué significa?

Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/07/los-sorprendentes-equilibrios-de-fases-del-agua
Muy buena explicación amigo @emiliomoron
Gracias amiga @yekamendez. Me alegra que te haya gustado, saludos.
Felicitaciones por tu nuevo blog en Word Press esta muy bonito.
Muchas gracias Breili, aprovecho para felicitarte por el tuyo, también me gustado mucho!