Non è solo genetica
Fino a non molti anni fa (ma talvolta anche al giorno d’oggi) si riteneva comunemente che il fenotipo (inteso come le caratteristiche morfologiche e funzionali) di un organismo fosse influenzato unicamente dal patrimonio genetico dell’individuo stesso: qualsiasi variazione nel fenotipo era ascrivibile a una qualche mutazione nel genoma dell’organismo stesso.
Per quanto questa affermazione sia in buona parte corretta, il progredire della conoscenza e delle tecniche molecolari ci ha posto davanti a questioni che non erano più spiegabili solo con la genetica classica. Un esempio tipico è quello dei gemelli omozigoti; essi condividono esattamente lo stesso patrimonio genetico eppure, per quanto possano somigliarsi, mostreranno sempre e comunque alcune differenze più o meno evidenti. Ma dal momento che il loro patrimonio genetico è identico, come si può spiegare un fenomeno di questo tipo? Non dovrebbero essere identici?

Immagine CC0 Creative Commons, Fonte
Domande come questa hanno portato i ricercatori a rispolverare concetti che più volte, nel corso della storia, erano stati teorizzati da alcuni pionieri, senza che fossero però mai veramente accettati e indagati seriamente.
L’epigenetica
Negli ultimi anni, allora, si è ripreso a parlare con forza di epigenetica, e questa disciplina è riuscita ad affiancare la genetica classica, completandola, in molti campi, tra cui la medicina e l’evoluzione.
Si intende per epigenetica l’insieme dei meccanismi, ereditabili, che sono in grado di variare il fenotipo di un organismo senza variarne il le sequenze di DNA. Quindi, mutazioni a livello epigenetico, dette epimutazioni, non sono in grado di modificare il patrimonio genetico degli organismi, ma possono variare il modo in cui questo viene espresso, dando luogo a fenotipi diversi.
A ben pensarci, risulta abbastanza chiaro come, in realtà, l’epigenetica regoli in modo abbastanza importante lo sviluppo di ciascuno di noi. Le cellule che compongono il nostro organismo provengono tutte da una stessa cellula, lo zigote, formatosi a partire da un gamete materno ed uno paterno; il genoma dello zigote si forma grazie alla fusione dei due gameti, “appropriandosi” del 50% del corredo genetico materno e del 50% di quello paterno. Ma se tutte le cellule derivano dallo zigote, come possono svolgere funzioni così diverse, e a volte incompatibili, tra di loro? La risposta risiede proprio nei meccanismi epigenetici che sono in grado di “inattivare” la parte di DNA che non serve a quella determinata cellula, rendendo magari più attiva la parte utile. Banalizzando, potremmo prendere come esempio una cellula nervosa e una muscolare. Nelle cellule muscolari è fondamentale l’espressione di due proteine motrici, actina e miosina; le sequenze che codificano per questi prodotti devono quindi risultare particolarmente “accessibili” in modo da poter essere trascritte facilmente. Al contrario, non avrebbe senso che queste proteine venissero prodotte in abbondanza in un neurone, dove potrebbe essere più importante la produzione di neurotrasmettitori. Eppure, neurone e cellula muscolare hanno esattamente lo stesso patrimonio genetico. La regolazione epigenetica, allora, farà in modo di lasciare più spazio ai geni per miosina e actina nei muscoli, e ai geni per i neurotrasmettitori nei neuroni.
A questa visione “tradizionale” dell’epigenetica gli studi recenti hanno aggiunto un elemento fondamentale: alcune modificazioni sono ereditabili.
Abbiamo detto che tutte le cellule derivano dallo zigote e quindi, se consideriamo l’ipotesi che per un errore o a causa di uno stimolo esterno avvengono delle epimutazioni a livello proprio dello zigote, sembra ragionevole che queste mutazioni possono poi trovare modo di esprimersi nell’organismo adulto. Allo stesso modo, facendo un ulteriore passo indietro, abbiamo visto come lo zigote si formi grazie ai due gameti parentali; altrettanto ragionevole potrebbe allora essere l’idea che epimutazioni nei gameti dei genitori riescano in qualche modo a influenzare l’espressione epigenetica del figlio.
Meccanismi molecolari
A dispetto della complessità di questo argomento, i meccanismi molecolari sono tutto sommato semplici e ben conosciuti:
- Metilazione del DNA. La metilazione del DNA è un processo molto ben conosciuto, e consiste nell’aggancio di gruppi metile ai filamenti di DNA. I gruppi metile proteggono l’elica dall’attacco di enzimi e proteine di diverso tipo. Il meccanismo di protezione è elementare e basata fondamentalmente su ingombri di tipo sterico: se è presente un gruppo metile, i fattori di trascrizione non avranno lo spazio fisico per raggiungere il DNA. Alta metilazione, quindi, corrisponde al silenziamento di quel tratto genico.
- Acetilazione degli istoni. Gli istoni sono delle proteine globulari attorno alle quali è normalmente avvolto il DNA. Quest’ultimo ha una leggera carica negativa, che facilita il legame con gli istoni, che sono invece leggermente positivi. L’acetilazione oscura la carica positiva, diminuendo l’affinità tra istone e DNA. Questo minor legame facilita l’interazione con i fattori di trascrizione. A una maggior acetilazione, quindi, corrisponde una maggior espressione.
- Metilazione degli istoni. Al contrario dell’acetilazione, la metilazione degli istoni causa repressione della trascrizione; essa, infatti, facilita il legame con una proteina specifica che condensa ulteriormente la struttura istone-filamento rendendo complicato l’accesso per i fattori di trascrizione. Altre forme di regolazione istonica, meno studiate, sono la fosforilazione e l’ubiquitinazione.
- Silenziamento genico. Vengono prodotti degli iRNA (interference) che interagiscono con gli mRNA (messaggeri) già prodotti impedendone la traduzione. Probabilmente l’espressione degli iRNA è comunque riconducibile a una delle modificazioni sopra descritte.
Questi meccanismi concorrono tutti a svolgere l’importante funzione di regolare l’espressione del genoma, senza mai andare a modificarlo. Può sembrare esagerato credere che sia sufficiente la modificazione nelle quantità dei trascritti per originare così tante differenze, ma negli ultimi anni molti evoluzionisti stanno iniziando a credere che questi processi giochino un ruolo di primaria importanza anche nell’evoluzione: differenze nell’espressione genica potrebbero essere alla base dell’evoluzione. Basti pensare alla grande somiglianza tra il nostro genome e quello di altri mammiferi molto diversi da noi. La differenza, allora, potrebbe risiedere proprio nelle diverse quantità di trascritti che produciamo.
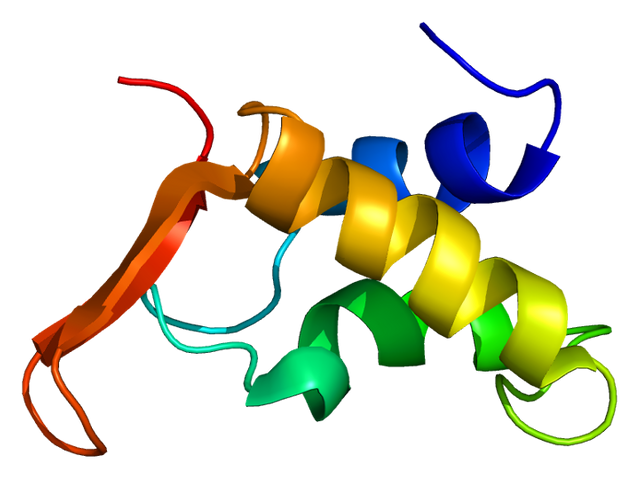
Immagine CC0 Creative Commons, Fonte
Struttura molecolare degli istoni.
Controversie
Fino a questo punto il discorso è abbastanza lineare e, in quanto supportato da numerose evidenze sperimentali, inconfutabile. I primi scontri all’interno della comunità scientifica sono esplosi quando i genetisti hanno cominciato a considerare la possibilità che le modificazioni epigenetiche potessero essere indotte anche dal contesto ambientale all’interno del quale si trova a svilupparsi un organismo.
Se infatti due gemelli omozigoti sono perfettamente identici a livello genetico, al netto delle possibili mutazioni casuali del loro DNA, cos’altro può causare una diversificazione dei fenotipi? Molto probabilmente si tratta proprio dell’ambiente, inteso come la molteplicità di situazioni differenti a cui ognuno deve far fronte nella propria vita.
Le emozioni, le paure, i traumi che ciascuno affronta nel corso della propria vita sono in grado di modificare il nostro codice epigenetico e di trasmettersi, almeno in parte, in modo ereditario.
Dopotutto, non è un concetto nuovo quello di un trauma in grado di segnare l’esistenza di una persona; possiamo oggi dire che, probabilmente, a livello molecolare questo meccanismo è mosso proprio dall’epigenetica. Provando di nuovo a banalizzare, ripetute situazioni di grande paura potrebbero portare a una continua espressione dei geni che “codificano per la paura”; l’organismo, allora, rende più accessibili questo pacchetto di geni che vengono usati spesso. Questo, però, si traduce in una trascrizione più efficiente anche in presenza di stimoli minori e, alla lunga, può generare una sensazione di paura frequente che potrebbe a sua volta causa stati di ansia.
Se queste modificazioni epigenetiche sono dunque ereditarie significa che le modificazioni a livello somatico indotte dall’ambiente sono, almeno in parte, trasmissibili per via ereditaria.
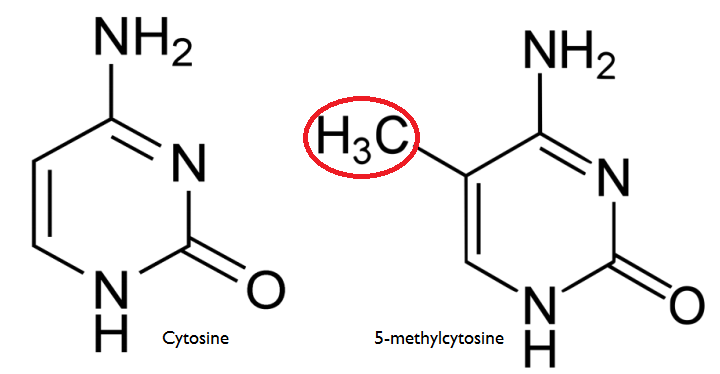
Immagine CC0 Creative Commons, Fonte
Metilazione di una citosina.
Questa possibilità va contro la maggior parte delle teorie moderne secondo cui nessuna modificazione somatica è in grado di attraversare la barriera di Weismann, una barriera più ideale che fisica, che impedisce alle mutazioni somatiche di “tornare indietro” e trasmettersi alla linea germinale diffondendosi.
Nonostante le iniziali opinioni contrarie, gli studi contemporanei stanno dimostrando e confermando con forza sempre maggiore questa tesi.
Evidenze sperimentali
Sono state condotte due importanti ricerche per cercare di comprendere meglio i meccanismi epigenetici. La prima, eseguita in laboratorio, ha visto l’utilizzo di topi sottoposti a condizioni particolarmente stressanti con l’obiettivo di osservare e indagare gli effetti sulla prole. La seconda, costituita più che altro da un’imponente opera di raccolta dati, mirava a considerare quali fossero stati gli effetti dell’inverno della fame sui figli delle persone che lo avevano vissuto in prima persona.
Nel primo esperimento, come detto, sono stati utilizzati dei topi a cui, durante la gravidanza, è stata fornita una dieta con apporto calorico dimezzato rispetto al normale. Come previsto, le madri hanno generato dei figli di taglia più piccola ma sani. L’aspetto interessante della ricerca, però, è stata l’osservazione dell’evolversi delle condizioni di salute di questi individui di seconda generazione (F2); questi, infatti, hanno manifestato al raggiungimento dell’età adulta una maggior predisposizione allo sviluppo di obesità e forme diabetiche. Ulteriore aspetto di interesse è stato il rilevamento di problemi simili, pur in forma attenuata, negli individui di terza generazione (F3), i nipoti delle madri esposte al trattamento. A questo punto, dando per scontata la trasmissione del codice epigenetico per via materna, i ricercatori hanno indagato se fossero riscontrabili differenze dalla condizione normale negli spermatozoi dei topi F2, ed effettivamente si è riscontrato un minor grado di metilazione in alcune zone del DNA.
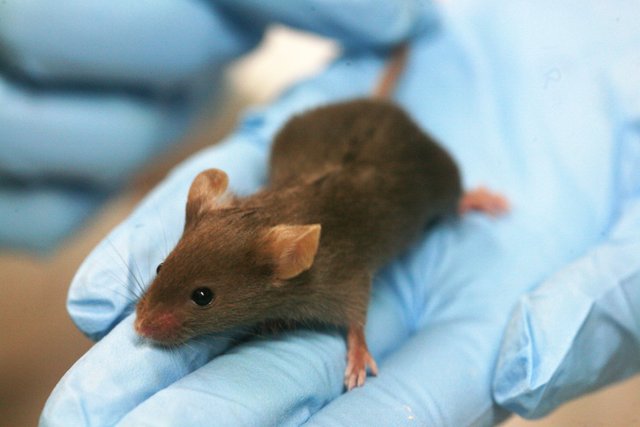
Immagine CC0 Creative Commons, Fonte
Il secondo esperimento, invece, è da considerarsi un test completamente naturale, in quanto non influenzato da condizioni di laboratorio. L’inverno della fame corrisponde al gelido inverno del 1944 durante il quale, sul finire della Seconda Guerra Mondiale, le truppe del Reich bloccarono tutti i rifornimenti diretti verso le zone occupate dei Paesi Bassi. Si calcola che, durante questo periodo, la dieta giornaliera dei civili corrispondesse ad un apporto calorico non superiore alle 500 calorie pro capite.
Ovviamente durante quell’inverno erano comunque numerose le donne in gravidanza, e lo studio ha cercato di recuperare i dati relativi a queste mamma per indagare gli effetti sulle generazioni seguenti.
Come era stato osservato nei topi, i componenti delle generazioni F2, quindi i figli di chi aveva sperimentato la carestia, da adulti hanno mostrato un’incidenza maggiore di malattie cardiovascolari e correlate al diabete e all’obesità. Non sono ad oggi disponibili i dati relativi alla generazione F3, i nipoti di quelle madri, in quanto queste persone stanno raggiungendo oggi la fascia d’età di interesse, ma la raccolta dati va avanti e si avranno idee più precise in poco tempo.
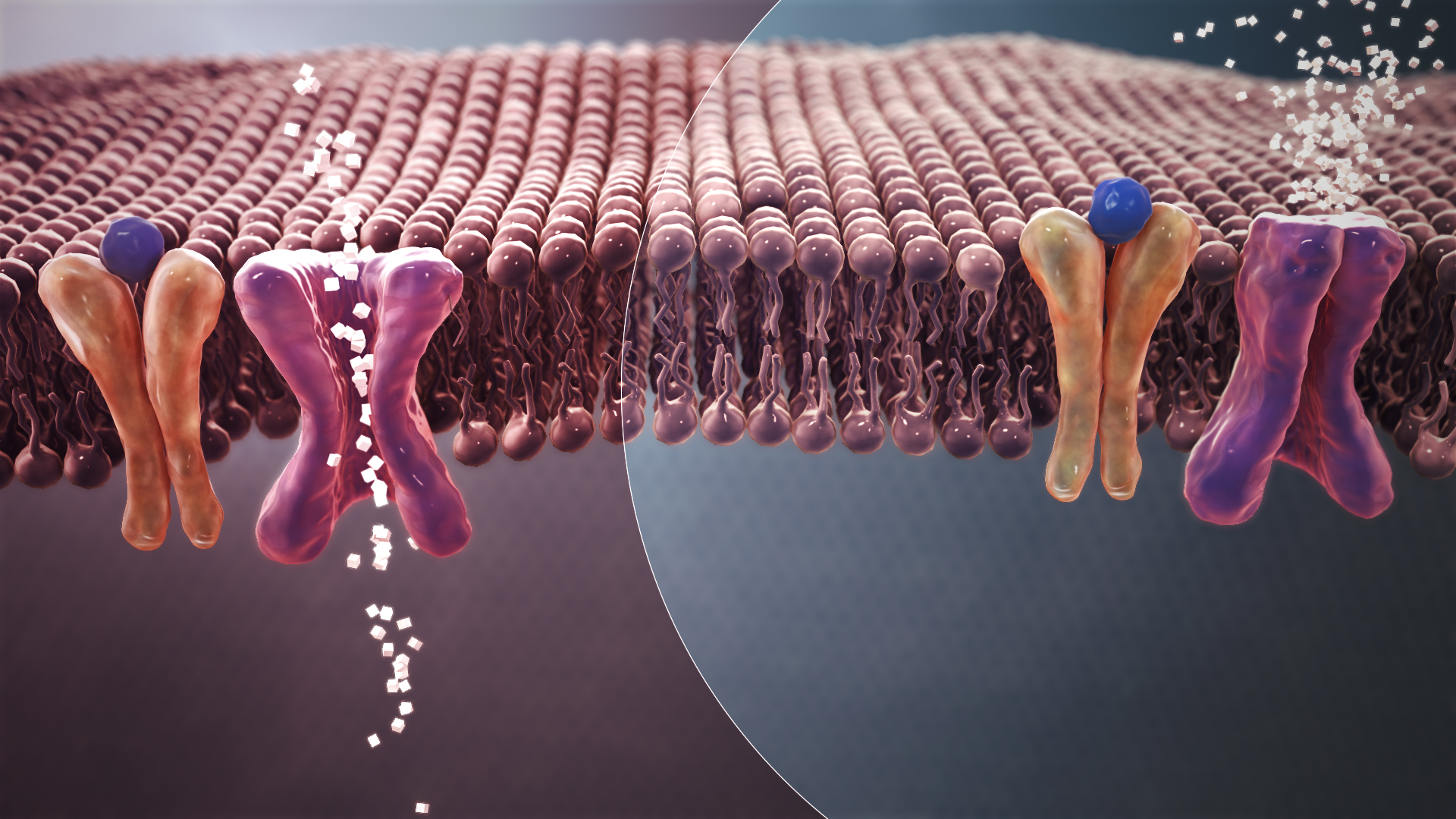
Immagine CC0 Creative Commons, Fonte
Meccanismo molecolare correlato all'insulino resistenza, diabete di tipo II.
Conclusioni
L’ipotesi dei ricercatori è quella che, durante una situazione di scarsità alimentare, avvengano nella madre delle modificazioni epigenetiche che rendano più efficienti i geni che trascrivono per elementi utili ad assimilare nutrienti. In questo contesto, infatti, è fondamentale ottenere dagli alimenti il massimo.
Queste modificazioni vengono poi ereditate dai figli, i quali, però, potrebbero trovarsi a non vivere più in un regime alimentare scarso come quello dei genitori. A questo punto l’organismo sarebbe ormai predisposto ad assimilare quante più calorie possibili; ma questo, in un regime alimentare “normale” può facilmente tradursi nella comparsa di obesità o altre malattie legate al metabolismo dei nutrienti.
Se volessimo fare un’ipotesi concreta, potremmo azzardare che l’aumento dei casi di malattie metaboliche e di obesità a cui assistiamo in questi anni sia legato a qualche fenomeno di questo tipo. La capacità di assimilare la maggior parte di quello che mangiamo potrebbe essere un’eredità lasciataci dai nostri nonni che, in molti casi, hanno sperimentato la rigidità della guerra. Oggi, invece, viviamo in un mondo dove il cibo non rappresenta (almeno in occidente) un fattore limitante e se ne fa spesso abuso. Il nostro codice epigenetico, però, non ha ancora avuto il tempo di “aggiornarsi” alla nuova situazione e ci impone di metabolizzare tutto come durante una carestia.
Il modello F3
Se questo modello si dimostrerà corretto, dovremmo osservare una situazione simile nella generazione F3. Oltre la generazione F3 è ancora tutto molto incerto. Il modello umano (più in generale quello dei mammiferi), prevede che durante la formazione dello zigote avvenga una decondensazione completa del DNA, e questo dovrebbe in un certo senso “resettare” il codice epigenetico. Questo implica che la linea germinale della generazione F3 sia dotata di un codice epigenetico completamente nuovo e, per tanto, la F4 sia sana e completamente diversa dalle precedenti.
Nei topi questa ipotesi sembra confermata, ora non ci resta che attendere che l’attuale F4 umana (i bambini di oggi) raggiungano l’età adulta per avere dei dati certi.
A parziale supporto di questa tesi si è osservato che esperimenti simili condotti nel nematode C. Elegans, privo del meccanismo di reset del codice, hanno portato alla trasmissione del codice epigenetico anche fino alla generazione F50.
Futuro
La speranza è quella, in futuro, di poter usare queste scoperte per curare malattie che oggi impattano in modo anche molto negativo sulla vita e sulla sua qualità.
Meccanismi epigenetici, infatti, sono anche alla base dello sviluppo di alcune forme tumorali: un’eccessiva metilazione dei fattori che controllano e impediscono lo sviluppo del cancro, per esempio, potrebbe facilitarne l’insorgenza.
L’esatta comprensione di questi meccanismi, che per loro natura sono mutevoli e, in un certo senso, accomodanti, potrebbe aiutare lo sviluppo di nuove ed efficaci terapie.

Immagine CC0 Creative Commons, si ringrazia @mrazura per il logo ITASTEM.
CLICK HERE AND VOTE FOR DAVINCI.WITNESS
Bibliografia
- Robin Holliday (2006). Epigenetics: A Historical Overview.
https://doi.org/10.4161/epi.1.2.2762 - Gerda Egger, Gangning Liang, Ana Aparicio & Peter A. Jones (2004). Epigenetics in human disease and prospects for epigenetic therapy.
https://www.nature.com/articles/nature02625 - Scott F. Gilbert, D. Epel (2009). ** Ecological Developmental Biology: Integrating Epigenetics, Medicine, And Evolution**.
http://works.swarthmore.edu/fac-biology/141/ - Shelley L. Berger, Tony Kouzarides, Ramin Shiekhattar and Ali Shilatifard (2009). An operational definition of epigenetics.
https://doi.org/10.1101/gad.1787609 - Elizabeth A. Mazzio & Karam F.A. Soliman (2011). Basic concepts of epigenetics: impact of environmental signals on gene expression.
https://doi.org/10.4161/epi.7.2.18764 - Leslie A. Pray (2004 – in progress). Epigenetics: Genome, meet your environment: as the evidence for epigenetics, researchers reacquire a taste for Lamarckism.

Logo creato da @ilvacca
Being A SteemStem Member
Penso sia un argomento molto affascinante e interessante, soprattutto per lo sviluppo di nuove terapie antitumorali. Lo hai saputo spiegare in modo chiaro, bravo :)
Grazie! ;)
Purtroppo, a parer mio, c'è ancora poca gente che ci lavora, e in molti preferiscono la genetica classica. Ma le prospettive in campo medico sono davvero interessanti...
Davvero interessante come argomento. Le piante sono i maestri dell'epigentica, la usano tantissimo come memoria cellulare. Alle piante serve molto piu' di noi dato che loro non possono muoversi e cercare ambienti piu' favorevoli
Nonostante siamo abituati a considerarle "organismi inferiori" le piante sono in grado di fare cose spettacolari, sotto diversi punti di vista. E il fatto che siano immobili è proprio il motore che ha permesso loro di sviluppare strategie così particolari.
Se non cambio programma il prossimo articolo dovrebbe essere sulle strategie delle orchidee...
Hai proprio ragione! Perfetto, sarei curioso di leggerlo :)
Gran bell'articolo. Complimenti per la cura dei dettagli e la chiarezza dei contenuti esposti.