¿Sabes que son las bases débiles?
Saludos estimados amigos de steemit, ¡especialmente a toda la comunidad científica de esta plataforma!

Gracias a que los antiacidos son bases débiles se pueden ingerir de forma segura. Fuente: diseño propio, imagen de antiacidos de Wikipedia.com con licencia CC BY-SA 3.0
Ya en publicaciones previas analizamos lo que les confiere la característica de ácido o base a las sustancias, comentando incluso sobre aquellas que exhiben una sorprendente acidez, por lo que quise continuar el tema analizando el lado opuesto de estas sustancias, prestando especial interés en este artículo a las denominadas bases débiles y sus características.
Es probable que con el término “base” no estemos muy familiarizados en lo cotidiano, quizás por el hecho de que genéricamente estas sustancias no son llamadas de este modo (caso contrario a lo que ocurre con los ácidos), pero forman una familia muy grande de compuestos que tienen como característica común su capacidad de aceptar protones o donar electrones. Entre las sustancias básicas quizás la más conocida es el hidróxido de sodio, muy utilizado como destapador de cañerías, el cual califica como una base fuerte por su gran capacidad para disociarse en solución acuosa y aceptar protones.
¿Y cuáles son entonces las bases débiles?
Bien, existen tres formas de definir lo que son las bases; según la teoría de Brönsted-Lowry, la más difundida para definir los conceptos de ácido y bases, se establece que una base “es una especie que acepta protones”[1], lo que quiere decir, en la mayoría de los casos, que posee un par de electrones solitarios al cual puede unirse un protón proveniente de un ácido; siendo la fuerza de una base el grado con la cual ésta es capaz de aceptar los protones. Con lo cual podemos decir que:
“una base débil es aquella sustancia con poca tendencia a aceptar protones”, por lo que se encontrará parcialmente protonada en solución.
Según la teoría de Arrhenius, una base “es un compuesto que produce iones hidróxido en agua”[1], entonces según esta definición, aquella base que produzca menos iones OH- en su disociación será más débil. Y finalmente, según la teoría de Lewis, una base es una especie química que posee un par de electrones solitarios cuando está en solución.
Por ejemplo, un ion óxido actúa como una base, cuando el óxido de magnesio (MgO) se disuelve en agua, el fuerte campo eléctrico del pequeño ion O2- arranca con mucha facilidad un protón de una molécula de agua:
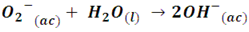
De esta manera, al arrancar el protón del agua el O2- es completamente protonado, desplazando totalmente la reacción hacia la derecha, siendo un ejemplo de base fuerte. Por otro lado, cuando el amoniaco se disuelve en agua también es protonado, pero el par de electrones no compartidos del átomo de nitrógeno en la molécula NH3 posee menor fuerza para atraer protones que la que presente un átomo más electronegativo como el oxígeno, por lo que, apenas una pequeña fracción de moléculas de amoniaco son protonadas para convertirse en iones NH4+.
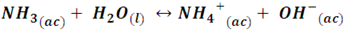
En esta reacción, se establece un equilibrio dinámico, en el cual entre la transferencia de protones desde las moléculas de amoniaco hacia las moléculas de agua y viceversa no se detiene, con lo cual se establece una concentración muy baja, pero constante, de iones NH4+ y OH- en la solución. Por consiguiente, se dice que el amoniaco es una base débil.
Si en lugar de agua, la base débil se pone en contacto con un ácido, esta sería capaz de neutralizar solo una pequeña proporción del ácido. Es por ello que algunas bases débiles, como la leche de magnesia, Mg(OH)2, son utilizadas como antiácidos, porque solo se quiere corregir la acidez del fluido gástrico y no neutralizarlo por completo o tornarlo alcalino.
Entonces, las bases débiles son sustancias que no se disocian completamente en iones cuando están en solución. Para comparar, mientras que aproximadamente el 100% de moléculas de una base fuerte se disocia en iones, tan solo entre un 5 y 10% de una base débil se disocia.
Constante de disociación básica
Cuando nos imaginamos la composición de una solución donde se ha disuelto una base débil en agua nos podemos imaginar una solución que contiene:
- las moléculas de la base sin disociar, y
- una pequeña proporción de iones OH- y el ácido conjugado producto de la transferencia del protón.
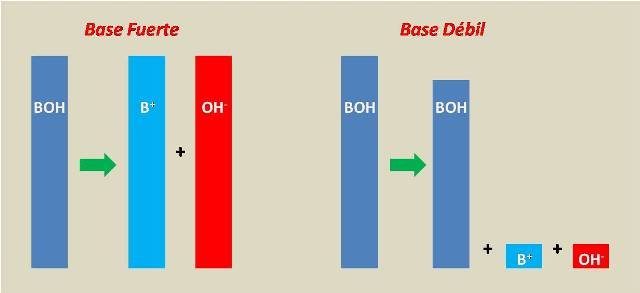
Comparación del grado de disociación de una base fuerte y una base débil. Fuente: @emiliomoron.
Por lo cual, la disociación de una base débil la podemos representar de dos maneras, según la definición de Arrhenius (la primera de las reacciones siguientes) o de Brönsted-Lowry (la segunda):
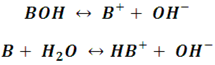
En ambos casos, la bese débil B o BOH, sufre una disociación, aunque las reacciones ocurren de diferente forma tienen en común dos aspectos; la producción de iones OH- y el establecimiento de un equilibrio, por lo que las reacciones son incompletas (por eso la doble fecha en la reacción), es decir, que solo un pequeño porcentaje de la base es capaz de disociarse y producir iones OH-, cosa que no pasa con bases como el NaOH (hidróxido de sodio).
Para analizar los equilibrios de disociación de las bases débiles se sigue un procedimiento similar que para los ácidos débiles, el cual podemos esquematizar tomando como ejemplo la metilamina (CH3NH2), ya que en su mayoría las bases débiles son de carácter orgánico. Entonces, cuando la metilamina se disuelve en agua se establece el siguiente equilibrio:
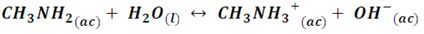
Por lo que la constante de equilibrio viene dada por:
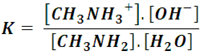
En comparación con el resto, se consumen muy pocas moléculas de agua en la reacción, por lo que su concentración ([H2O]) se puede considerar constante, entonces la expresión se puede escribir de la siguiente forma:
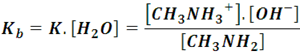
Donde Kb se conoce como constante de disociación básica, la cual a 25 ºC es de 4,4x10-4[2].
Esta constante nos permite determinar entre otras cosas, el pH de una solución básica y el porcentaje de disociación de la misma.
¿Qué otras características tienen las bases débiles?
- Bajos porcentajes de ionización
Si en el ejemplo anterior consideramos que inicialmente se tiene una concentración inicial de metilamina de 0,5 M. Podemos estimar el grado de disociación determinando cuanto de la base débil se ha disociado, veamos como quedan las concentraciones al establecerse el equilibrio de la siguiente manera:
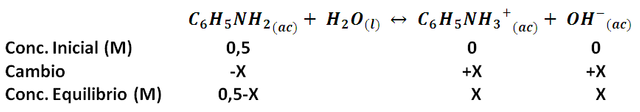
La expresión de equilibrio nos quedaría como:
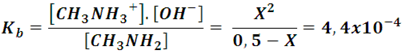
Lo que conduce a una expresión de segundo grado cuya solución nos dice que la concentración de metilamina (X) es de 0,0146 M, de modo que el grado de disociación de la base a estas condiciones es:

Basta mirar el resultado para comprender la gran diferencia en la disociación de una base débil y una base fuerte.
En su mayoría son aminas
La mayoría de las bases débiles en la naturaleza son de carácter orgánico y surgen frecuentemente de la descomposición de compuestos nitrogenados en ausencia de aire. Por ejemplo, las aminas, son compuestos derivados del amoniaco cuando es reemplazado uno o varios átomos de hidrógeno por un grupo alifático. Estos malolientes compuestos le dan su característico olor al pescado muerto, por lo que si desean disfrutar mejor de su comida, compren un pescado fresco o báñenlo con jugo de limón para neutralizar estas bases.Son las bases conjugadas de ácidos fuertes
Si observamos la reacción de disociación del ácido acético, y la comparamos con la reacción del ion acetato en agua, podemos notar que existe una relación entre las constantes de disociación de ambos compuestos. Por ejemplo:
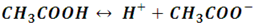
Por lo que su constante de disociación es:

Ahora bien, la base conjugada CH3COO- reacciona con el agua de acuerdo a la siguiente reacción:
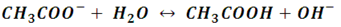
De la cual, tiene como constante de ionización la siguiente expresión:
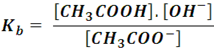
Si tomamos el producto de las dos constantes:

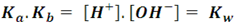
Que es el producto iónico del agua (Kw). Así, para cualquier par ácido-base se cumple que:
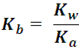
De lo que podemos decir que, mientras más fuerte sea un ácido (valor alto de Ka), su base conjugada será más débil.
- En solución acuosa originan pH alcalinos moderados
Cuando tenemos una solución diluida de una base débil, esperamos que su pH sea ligeramente alkalino, un pH mayor a 13 sería muy básico, mientras que un pH de 8 está muy cerca del neutro, lo razonable es que este cercano a 10[3].

pH de algunas sustancias básicas comunes. Fuente: tomada de Chemistry Libre Texts, librería con contenido bajo licencia CC BY-NC-SA 3.0, y adaptada por @emiliomoron.
Las bases débiles y su relación con los alimentos
En los alimentos podemos encontrar bases débiles constituidas por aminas biogénicas, formadas por descarboxilación de aminoácidos o por aminación o transaminación de aldehídos y cetonas[4], estos compuestos son producidos por el metabolismos de microbios. Como les había mencionado, en los peces podemos encontrar la trimetilamina en bajas concentraciones, pero en los peces muertos su concentración aumenta por la acción de bacterias capaces de reducir el óxido de trimetilamina. Esto también ocurre en la degradación de las frutas.
Pero esta acción microbiana no siempre es desagradable como en el caso del pescado, por ejemplo, esta actividad es inducida en el caso de la fermentación de vinos y vegetales, ya que las aminas pueden contribuir con el sabor y el aroma.
El bicarbonato de sodio, mejor conocido en la cocina como polvo de hornear, actúa como una base débil dada su pobre ionización en agua, y en presencia de ácidos genera dióxido de carbono:
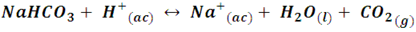
Esta reacción genera la expansión del producto horneado, reproduciendo el efecto de la levadura.
Los amantes del chocolate quizás quieran saber que su procesado mediante un método denominado “proceso holandés” consiste en tratar las semillas tostadas de cacao con una solución alcalina diluida, utilizada para neutralizar los componentes ácidos, obteniendo un producto con una mejor textura, menor acidez y por consiguiente un sabor más suave[5].

La textura y suave saber del chocolate se logra gracias a las bases débiles. Fuente de la imagen wikipedia.com, licencia CC BY-SA 3.0
Referencias
- Atkins, P., Jones, L. (2006). Principios de química. Editorial Médica Panamericana S.A.
- Chang, R. (2002). Química. Editorial McGraw-Hill.
- Chem.libretexts. Weak Bases
- Chem.libretexts. The pH of Solutions of Weak Bases
- Wikipedia.com. Proceso holandés

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
many thanks friends!
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Muchas gracias por el apoyo constante equipo Entropía
Muchas gracias por su consieración amigos!
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thanks for the support!
Que tal amigo Elias. En cuanto a tu pregunta no soy experto chocolotero, más que degustarlo como todos jeje, según leí el proceso holandés es el proceso tipico para el tratamiento del cacao, ya en la elaboración del chocolate cada quién le pone su toque, también se podría utilizar el cacao natural (sin alcalinizar) obteniendose un producto con un color y sabor diferente, el proceso holandés es el más utilizado porque intensifica el sabor, por ello es casi que el universal. Y gracias a ti por pasar a leer y dejar tu comentario, saludos!
Muy completa la información que nos traes por acá, no soy muy amante de los antiacidos pero hay personas que los necesitan a diario es bueno saber que su base es suave.
Hay detalles que no conocia: El bicarbonato de sodio, mejor conocido en la cocina como polvo de hornear. Pense que eran diferentes conponentes esta no la sabia.
Lo mejor el chocolate.
Saludos @sacra97, gracias por visitar mi blog. También conozco personas que requieren de antiácidos con frecuencia, es bueno conocer su principio activo. Me alegra que pudieras descubrir algo nuevo con el artículo, es la idea de compartir la información por acá, y sin duda, lo mejor es el chocolate jeje. Gracias por tu comentario.
Excelente contenido el que nos presenta mi estimado @emiliomoron, muy completo. Saludos....
Gracias amigo @felixrodriguez, me alegra que le gustara el contenido. Mis saludos.
Saludos @emiliomoron, me encantó el post porque además de explicar en qué consisten las bases débiles, lo relacionas con ejemplos del día a día ¿Quien no ha sentido el olor del pescado que ha dejado de estar fresco? Por otro lado, el bicarbonato de sodio que es muy usado en la preparación de las tortas o pasteles, el cual es un excelente aliado para lograr ese tan anhelado "crecimiento de la torta". Por supuesto el ejemplo más agradable fue el del chocolate; si había leído algo del tratamiento con sustancias alcalinas para disminuir su acidez y hacerlo más agradable al paladar. Gracias por tan interesante tema.
Saludos Dra. @elvigia, me alegra que le gustara el artículo. La química esta en nuestro alrededor, y cuando asociamos estos conceptos con ejemplos cotidianos podemos entender aún mejor de que se trata, ciertamente quién no ha tenido alguna de esas experiencias, sería difícil no ubicarse en el contexto y trasladarlo inmediatamente a alguna experiencia personal. Gracias a usted por pasar a leer y dejar su comentario.