Espectro atómicos

Saludos a toda la comunidad de steemit, en esta oportunidad quiero compartir con ustedes uno de los temas mas interesantes que vi en mi curso de física moderna, el cual trata acerca de los espectros registrados en un espectroscopio y originados por la luz de diferentes elementos expuestos a alta temperatura.
Antes de empezar quiero definir ciertos conceptos que son básicos e importantes para la información de este post. La luz es una onda electromagnética, capaz de viajar en el vació, pero que al pasar de un medio a otro con cierta inclinación cambia de dirección a esto se le conoce como refracción. Por otro lado la luz visible para nosotros solo representa una pequeña parte del espectro electromagnético, ubicado entre 400nm (ultravioleta) y 750nm (infrarrojo), por encima y debajo de ese valor no podemos ver las radiaciones que incide sobre nosotros, como por ejemplo las ondas de radio y los rayos X, ahora dado que son ondas se consideran en estas ciertas magnitudes, como la longitud de onda y frecuencia, en este caso ambos elementos son inversamente proporcionales, esto quiere decir que a mayor frecuencia en una radiación electromagnética menor es la longitud de onda de la misma y viceversa , también cabe aclara que mientras mas pequeña es la longitud de onda de una señal, mayor energía posee [1]. Por ultimo a las radiaciones electromagnéticas como la luz se les llama onda, dado al comportamiento que se ha observado de ellas al comportarse como una dicho efecto.
Cuando se observa un objeto iluminado por una fuente de luz natural o artificial, se es perfectamente capaz de describir cómo es ese objeto, qué propiedades tiene y qué color presenta, es decir, se conoce su aspecto externo. Pero ¿cómo conocer su aspecto interno?. Pues bien, la Física proporciona una técnica para ello: la espectroscopía, que en síntesis actúa de forma similar a como lo hace la vista cuando se mira un objeto.En efecto, los átomos y moléculas que forman la materia no se encuentran en reposo, sino que están en constante movimiento y son capaces de absorber y emitir ciertas formas de radiación electromagnética, que son características de los átomos y moléculas de cada sustancia, por lo que un estudio de las frecuencias y longitudes de onda de estas radiaciones, proporcionan información sobre la naturaleza de los elementos que la emiten o absorben. tal información forma lo que se denomina el espectro característico de una sustancia.


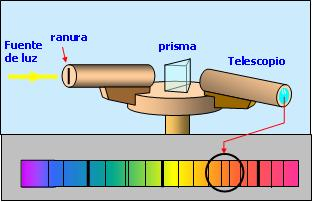
En 1.859, el físico alemán Gustav Robert Kirchhoff (el primero de la imágenes que estan a la derecha)(1.824-1.887) y el químico también alemán, Robert Wilhelm Bunsen(el segundo de la imagen)(1.811-1899) fueron los primeros en darse cuenta de que cada elemento emite y absorbe luz de ciertos colores, que componen su espectro característico. Desarrollaron el primer instrumento moderno para estudiar los espectros, el espectroscopio de prisma y, lo aplicaron al análisis químico. Este instrumento, que es uno de los dos tipos principales de espectroscopio, está formado por una rendija, un conjunto de lentes, un prisma y un ocular. La luz que va a ser analizada pasa por una lente colimadora, que produce un haz de luz estrecho y paralelo, y a continuación por el prisma. Con el ocular se enfoca la imagen de la rendija. De hecho, lo que se ve son una serie de imágenes de la rendija, conocidas como líneas espectrales, cada una con un color diferente, porque el prisma separa la luz en los colores que la componen.
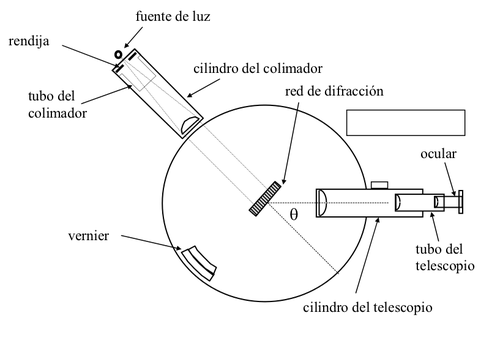
Un segundo tipo de espectroscopio usado habitualmente es el espectroscopio de red o de rejilla, empleado por primera vez a comienzos del siglo XIX por el físico alemán Joseph von Fraunhofer(1.787-1.826).
En estos instrumentos, la luz se dispersa mediante una red de difracción en lugar de un prisma. Una red de difracción es una superficie especular de metal o vidrio sobre la que se ha trazado un elevado número de líneas paralelas. Una buena red tiene una gran potencia dispersiva, por lo que permite mostrar detalles mucho más finos en los espectros. Las líneas de la red de difracción también se pueden trazar sobre un espejo cóncavo, de forma que la red sirva al mismo tiempo para enfocar la luz y sea innecesario el uso de lentes. En un espectroscopio de este tipo, la luz no necesita pasar por ninguna sustancia transparente, por lo que estos instrumentos se emplean en toda la región ultravioleta y en la región de rayos X.
He hablado hasta ahora de los espectroscopio y su utilidad para analizar espectros, pero no he definido tales conceptos, por ello procederé con una explicación de ello. Un espectro es una serie de colores semejante a un arco iris -por este orden: violeta, azul, verde, amarillo, anaranjado y rojo- que se produce al dividir una luz compuesta como la luz blanca en sus colores constituyentes. El arco iris es un espectro natural producido por fenómenos meteorológicos.

Puede lograrse un efecto similar haciendo pasar luz solar a través de un prisma de vidrio, o haciendo incidir luz compuesta, natural o artificial en una red de difracción(como mencione anteriormente), si la fuente de luz es una sustancia específica, se habla de espectro característico. Cada elemento químico tiene un espectro característico, es decir, una distribución determinada de la radiación electromagnética. En general, un espectro es la banda de radiación electromagnética emitida o absorbida por una sustancia en circunstancias dadas. Los espectros pueden clasificarse atendiendo a varios criterios, dos de ellos son:
En estos espectros la radiación es emitida por una sustancia, la cual es analizada para determinar las longitudes de onda particulares producidas. La emisión de radiación se puede inducir por varios métodos, como: elevación de temperatura, bombardeo con electrones, descargas eléctricas, absorción de radiación de más alta frecuencia, etc.
Estos espectros se obtienen haciendo pasar por una sustancia un flujo continuo de radiación electromagnética, parte de la cual es absorbida por la muestra, y entonces se analiza la radiación restante para determinar las longitudes de onda absorbidas.
Espectros compuestos de un número de rayas discretas correspondientes a longitudes de ondas distintas de la radiación emitida o absorbida. Los espectros de rayas se producen por átomos o iones simples en gases. Cada raya corresponde a un cambio de órbita de un electrón, con emisión o absorción de radiación.
Estos espectros están formados por una serie de bandas brillantes cada una de las cuales es similar a un fragmento del espectro continuo, separadas por zonas oscuras. Estas bandas no son en realidad continuas, sino que están formadas por muchas líneas muy juntas que pueden resolverse mediante espectroscopios de alta resolución. El espaciado de las líneas en cualquier serie de bandas moleculares depende de si el espectro es rotacional o vibracional
Como verán existen varias forma de tener espectros, pero la explicación de esto se encuentra en el misterioso y mágico mundo de la física cuántica, pues la razón por la cual se forman estas lineas de colores es por que cuando se le suministra una alta cantidad de energía como una descarga eléctrica a un gas de cierto elemento a baja presión, los átomos que componen este gas comienza a colisionar entre si, quedando algunos de ellos en un estado con una energía mayor que un átomo en estado normal, esta energía extra la llevan los electrones que se ubican en órbitas inestables de manera que al liberarse de esta para pasar a una órbita estable o de menor energía libera una radiación en forma de luz(fotones), que son las lineas espectrales, pero ¿por qué se visualizan varias lineas de colores?, es porque en los átomos existen varias orbitas, y cuando un electrón pasa de una órbita de mayor energía a otra de menor energia no lo hace necesariamente lo hace a la mas cercana, sino que lo puede hacer desde la ultima órbita a la primera instantáneamente (lo cual corresponde a un color del espectro), o lo hace desde la penúltima órbita a la primera (corresponde a otro color), o de la antepenúltima a la segunda (es otro color), es decir, el electrón al pasar de diferentes órbitas libera cierta radiación correspondiente al cambio que hace en las órbitas, este fenómeno lo describió muy bien Niels Bohr en 1913 cuando púbico, su modelo atómico.
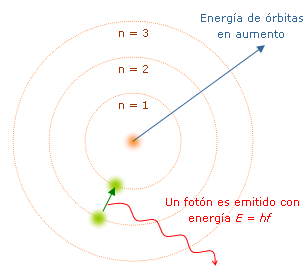
Tal modelo planteaba que las órbitas de los átomos estaban cuantificadas, de manera que cada órbita le corresponde cierta energía, esta teoría explico exitosamente el espectro atómico del hidrógeno, el elemento mas abundante y sencillo de la naturaleza pues solo posee un electro que lo órbita, pero para átomos como mayor cantidad de electrones, no se puede utilizar este modelo, ya que para estos elementos es complejo estimar como son sus "órbitas", ademas las interacciones entre ellas es muy complejo determinar, sin embargo la elaboración espectroscopio avanzados de alta resolución se ha logrado tener los espectros de la mayoría de los elemento, así como también de métodos numéricos utilizados en computadoras de gran capacidad para crear modelos mas acertados para así tener datos teóricos acerca de estos espectros.
De seguro han visto avisos con luces de neón, argón, kryton, helio y xenón los denominados gases nobles, pero así como sus luces son característica de estos elementos sus espectros son aun mas, como ya mencionamos cada elemento posee un espectro caracteristico, o mejor dicho su huella dactilar queda impreso en estos espectros, de modo que cada elemento es identificable según su espectro como por ejemplo.
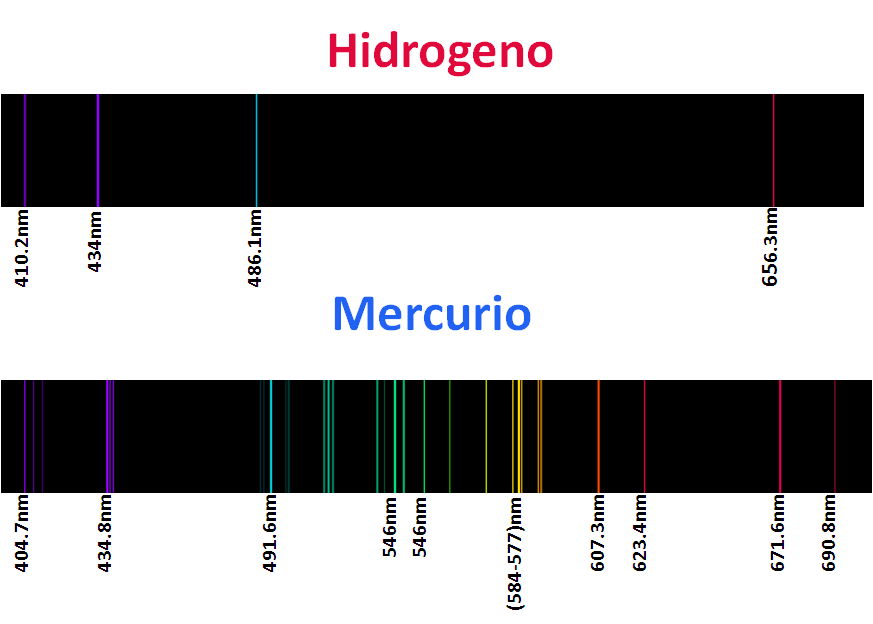
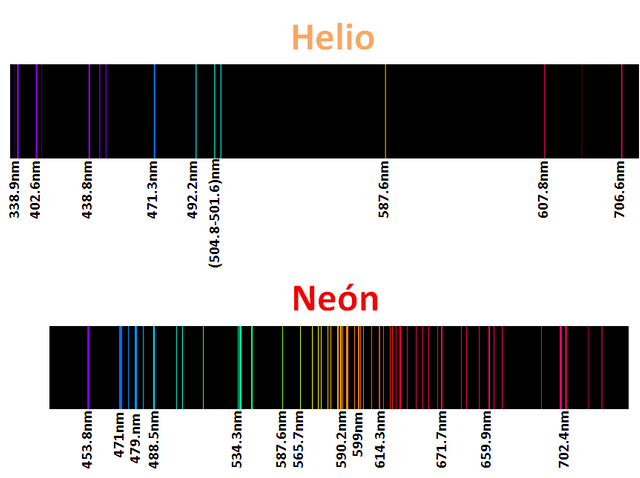
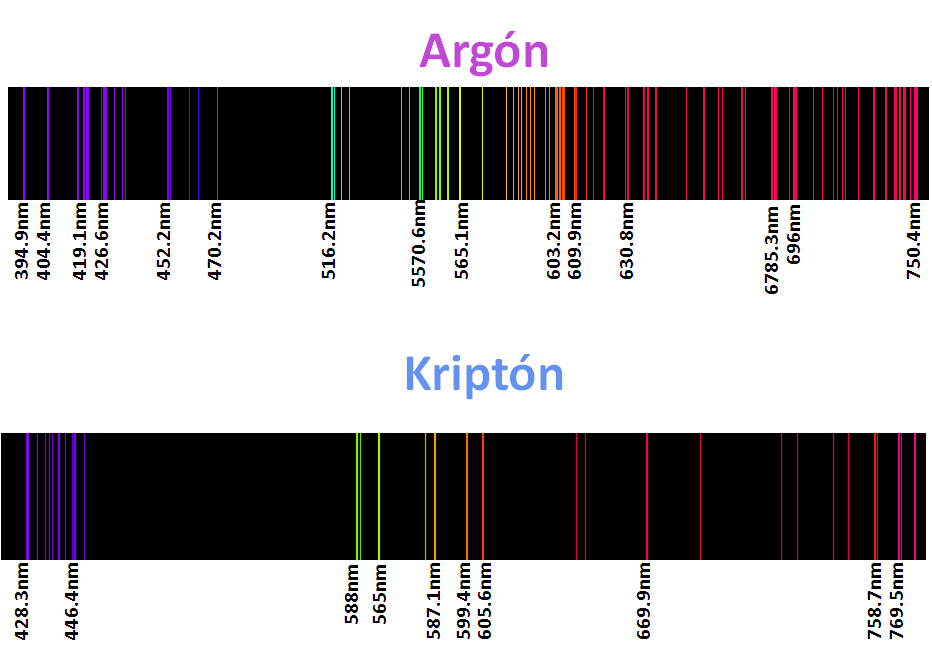

La aplicación de esta técnica es la base utilizada en la astronomía para conocer la composición de las estrellas, analizando la luz que registran lo telescopio, y luego de un extenso y meticuloso estudio con programas computacionales pueden llegar a estimar la composición del objeto de estudio. Para mi este tema en verdad fue y es muy interesante, pues una vez mas, se puede ver el efecto que tiene las partículas del reino cuántico en nuestra realidad, lo cual agranda la importancia de esta rama de la física. Por otro lado el modelo atómico de Bohr es una representación elegante que se puede evidenciar en sus ecuaciones, las cual no coloque para no interferir el tema con las matemática que ademas implicaba conceptos mas profundo de la física, pero lo importante es que a todos estos descubrimientos con el transcurso del tiempo, se les encuentra una aplicación que pueden ser de beneficio y progreso para la humanidad
Espectros tomados del programa AtomicSpectra 1.0, y editados en Power point 2007
Refencias:
ACOSTA, VIRGILIO; COWAN, CLYDE. Curso de Física Moderna. Editorial Harla, S.A., México, 1.975. Págs. 124-144. 512 pp.
ALONSO, MARCELO; FINN, EDWARD J. Física, Volumen II: Campos y Ondas. Fondo Educativo Interamericano, S.A., México, 1.976. Págs. 933-947. 1.067 pp.
EISBERT, ROBERT. Física Cuántica. Editorial Limusa, S.A., México, 1.983. Págs. 115-151. 833 pp.
Tremendo post, es interesante llenar steemit de ciencia. Gracias por compartir, el equipo Cervantes apoyando a la comunidad.
Gracias @sancho.panza por el apoyo, para mi es un placer compartir mi humilde conocimiento y poder contribuir con el crecimiento de la comunidad hispanohablante en steemit
Congratulations @joseg! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on any badge to view your own Board of Honor on SteemitBoard.
For more information about SteemitBoard, click here
If you no longer want to receive notifications, reply to this comment with the word
STOPJajajaja esos espectros se me hacen algo conocidos.... Jajaja felicidades amigo te quedo espectacular, tu siempre dando lo mejor @joseg
no se de que estas hablando..! :) pero gracias @dojeda es grato saber que este post fue de tu agrado