Análisis de Pigmentos fotosintéticos

Hola Steemeros, soy estudiante de biología marina en la Universidad de Oriente, quería compartir con ustedes una clase que me toco dar en una materia llamada Cultivo de plancton, se trata sobre el análisis de pigmentos que muchos de estos microorganismos, más que todo este análisis va dirigido a las especies fitoplanctonicas, que son aquellas que producen el oxigeno de los cuerpos de agua, así como las plantas lo hacen en la tierra. Espero de verdad que les guste y sea informativo para ustedes.
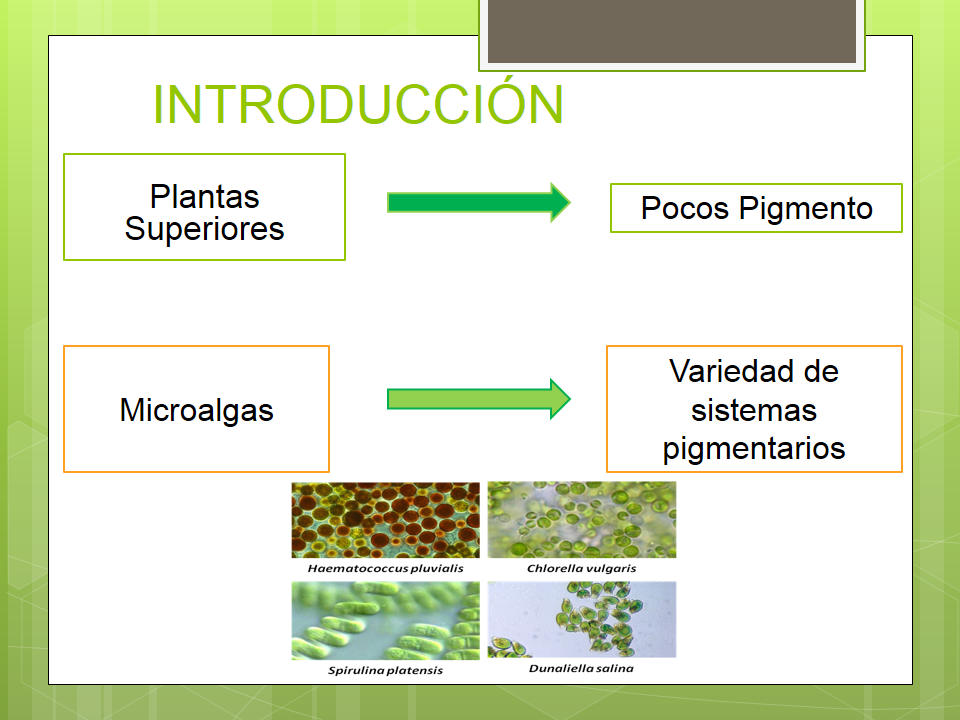
A diferencia de las plantas superiores, en las que un solo sistema constituido por unos pocos pigmentos ha llegado a ser dominante, las microalgas han desarrollado una gran variedad de sistemas pigmentarios que, en su conjunto, presentan un gran número de compuestos diferentes que suelen aparecer en forma mezclas complejas (Jeffrey, 1980).
Esta complejidad en la dotación pigmentaria de las microalgas hace que, en muchos casos, puedan poseer pigmentos o combinaciones de pigmentos que son diagnósticas de su pertenencia a un determinado grupo taxonómico. Esto ha llevado al empleo del análisis de pigmentos en estudios filogenéticos y como herramienta de caracterización de comunidades fitoplanctónicas en aguas naturales.

También se ha empleado el análisis de pigmentos en los estudios relacionados con la producción primaria, el crecimiento y la fisiología de microalgas, utilizándolos, por ejemplo, como estimadores de la contribución de diferentes clases algales a la producción planctónica total. Puesto que el aparato fotosintético es capaz de reflejar las respuestas del fitoplancton a variaciones en factores ambientales, las alteraciones en los perfiles pigmentarios pueden emplearse como estimadores del estado fisiológico, por ejemplo ante situaciones de déficit de nutrientes o bajo diferentes regímenes lumínicos.
Por otra parte, varios trabajos han demostrado la posibilidad de seguir diversos pasos en las cadenas tróficas que, en medios acuáticos, tienen el fitoplancton como punto de partida, mediante análisis pigmentario.
Cabría citar, por último, la creciente utilización del análisis de pigmentos en las verificaciones en tierra (o a bordo) de las estimaciones remotas (satélites o aéreas) de biomasa fitoplanctonica (Millie et al., 1993)

Los objetivos fueron planteados en relación a la información encontrada sobre el tema.

Los pigmentos naturales son biomoléculas presentes en la biomasa de microalgas. Además del carotenoide y ficobilinas, las clorofilas son moléculas que se producen de forma integral en estos microorganismos.
Diversas cepas de cianobacterias presentan la capacidad de producir compuestos de interés como la producción de pigmentos, proteínas o de metabolitos con actividad biológica, es necesario optimizar su crecimiento en función de la temperatura, irradiancia, salinidad, agitación, concentración y naturaleza de nutrientes en condiciones de laboratorio (Hoffmann 1988).
La determinación de la concentración de pigmentos fotosintéticos nos permite estimar la biomasa y la capacidad fotosintética del fitoplancton. La calidad, distribución y relación entre las distintas clases de pigmentos nos indica el estado fisiológico de la comunidad y la composición del fitoplancton en cuanto a grupos algales.
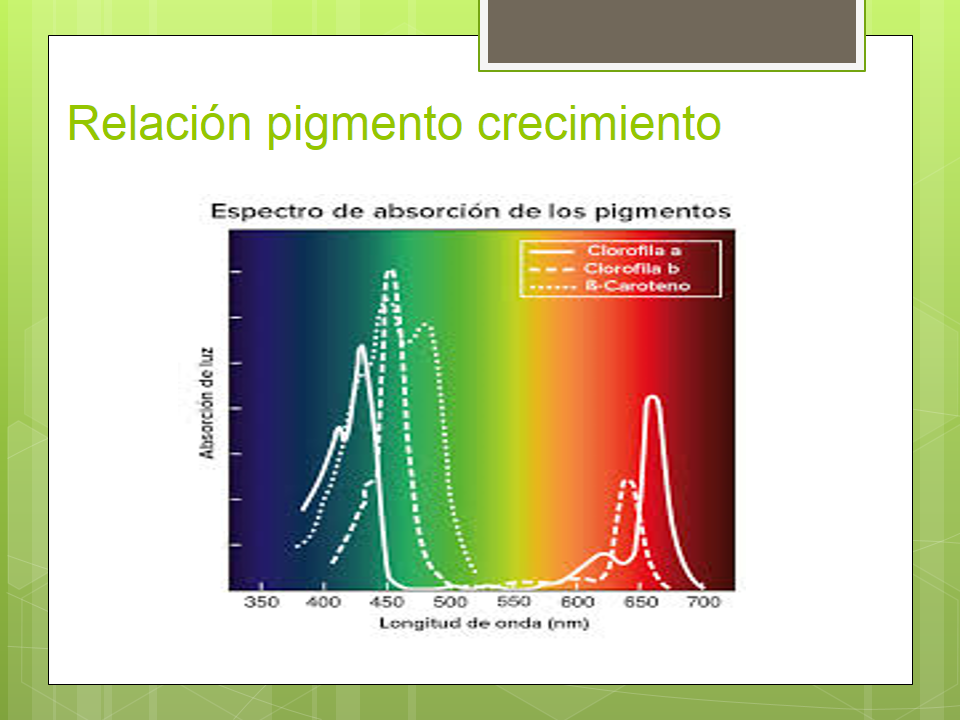
En la fotosíntesis, la energía solar se convierte en energía química mediante organismos fotosintéticos. Sin embargo, en la fotosíntesis no se usan de igual manera todas las distintas longitudes de onda en la luz del sol ya que los organismos fotosintéticos contienen moléculas llamadas pigmentos que absorben solo longitudes de onda específicas de la luz visible, mientras que reflejan otras.
El conjunto de longitudes de onda que absorbe un pigmento se conoce como su espectro de absorción. En el siguiente diagrama, puedes ver los espectros de absorción de tres pigmentos importantes en la fotosíntesis: clorofila a, clorofila b y β-caroteno. El conjunto de longitudes de onda que un pigmento no absorbe, se refleja, y la luz reflejada es lo que vemos como color. Por ejemplo, percibimos las plantas de color verde por su gran contenido de moléculas de clorofila a y b, que reflejan luz verde.
La mayoría de organismos fotosintéticos tienen una diversidad de pigmentos, lo cual les permite absorber energía de una amplia gama de longitudes de onda. Aquí, veremos dos grupos de pigmentos importantes en las plantas: clorofilas y carotenoides.
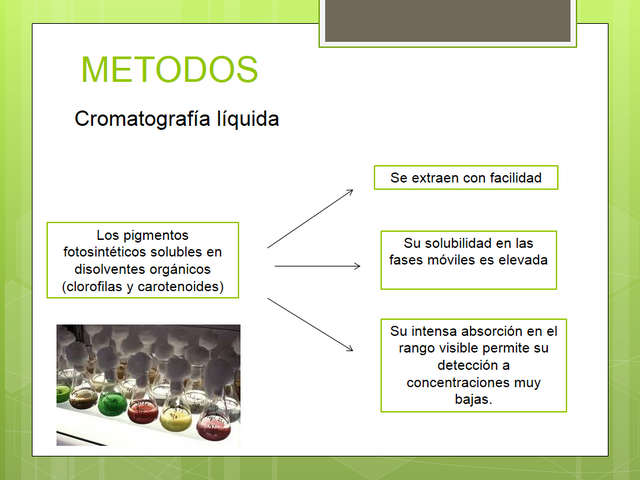
Los pigmentos fotosintéticos solubles en disolventes orgánicos (clorofilas y carotenoides), son candidatos idóneos al análisis por cromatografía líquida de alta eficacia (HPLC), ya que se extraen con facilidad, su solubilidad en los disolventes empleados como fases móviles es elevada y su intensa absorción en el rango visible (así como en el caso de las clorofilas sus propiedades fluorescentes) permite su detección a concentraciones muy bajas.
Sin embargo, la separación cromatográfica completa de los pigmentos de una muestra de origen fitoplanctónico se enfrenta con dos problemas:
-Por una parte, el conjunto exhibe un amplísimo rango de polaridades que abarca, para los carotenoides, desde hidrocarburos a xantofilas polares en las que el oxígeno se presenta formando parte de diferentes funcionalidades y, para las clorofilas, desde las formas esterificadas con fitol a formas muy polares que contienen una función ácido carboxílico libre.
-Por otra parte, muchos de los compuestos se distinguen unos de otros por pequeñas diferencias estructurales. Es frecuente encontrar, en la misma muestra, pares de pigmentos que se diferencian exclusivamente en la presencia o ausencia de un doble enlace -clorofilas c¡ y c2, formas mono- y divinílicas de las clorofilas a y b- o incluso de isómeros que se distinguen por la posición en que se encuentre dicha insaturación - clorofila c2 y Mg-DVP, luteína y zeaxantina, etc .... Esto origina la aparición de grupos de pigmentos cuya separación es difícil con técnicas de HPLC convencionales.

Esto es un resumen de los pasos que lleva este metodo.
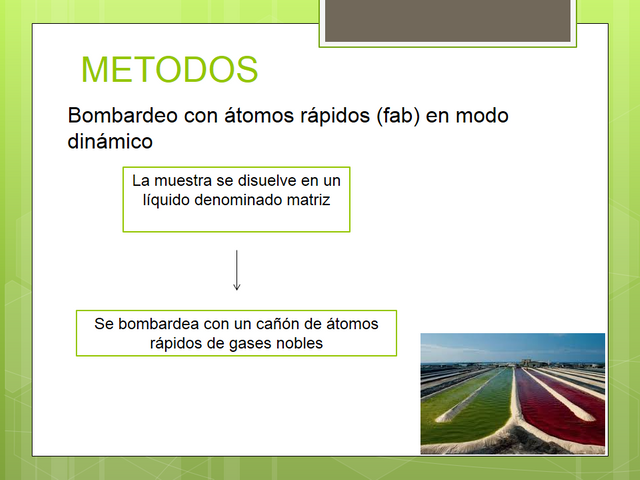
En la técnica de FAB la muestra se disuelve en un líquido denominado matriz. Este disolvente debe tener un elevado punto de ebullición para que su tensión de vapor, en las condiciones de alto vacío en las que opera un espectrómetro de masas, sea muy baja; además debe ser un buen disolvente para las muestras. En el caso de clorofilas y carotenoides resultan especialmente adecuados 3-nitrobencilalcohol (para espectros en modo positivo) y trietanolamina (modo negativo). Esta disolución se bombardea con un cañón de átomos rápidos de gases nobles (energías de 2 a 10 kV) o de iones de Cs+ (35 kV), produciéndose la desorción contínua de iones característicos de la matriz y de la muestra, normalmente en forma de iones moleculares o pseudomoleculares positivos y negativos. El proceso de ionización de la muestra tiene lugar mediante la acción combinada de mecanismos de transferencia de momento cinético, transferencia de electrones y fragmentación aleatoria.
En su variante FAB dinámico la muestra se introduce en forma líquida hasta la misma fuente iónica del espectrómetro de masas a flujos contínuos de 1-20 ¡.tl.min-1, por medio de un capilar inerte de sílice fundida que termina en una cabeza dotada de un material absorbente que retira el exceso de eluyente y matriz. La ionización se produce de forma análoga a lo que sucede en el modo estático. La matriz se debe añadir al eluyente de cromatografía en una proporción aproximada de un 5%.
Muchas veces la adición de la matriz al eluyente no es posible, pues su presencia perjudica a la separación cromatográfica y en este caso debe utilizarse un flujo post-columna de matriz empleando una bomba auxiliar.
La aplicación de esta técnica a clorofilas ha sido estudiada por Van Breemen et al. (1991). Tanto las formas fitoladas (clorofilas a y b) como las ácidas ( clorofílidas) o sus correspondientes derivados demetalados (feofitinas y feofórbidos) dan intensos iones moleculares protonados [M+H]+ y fragmentación escasa pero significativa, destacando el fragmento correspondiente a la pérdida de fitol [M+H-278]+. Un espectro de masas FAB de clorofila a se muestra en la Figura 7.
En el caso de carotenoides (Van Breemen et al., 1993), el espectro FAB contínuo prácticamente se circunscribe al ion molecular [M]+, que aparece como el correspondiente aducto protonado [M+H]+ en las xantofilas más oxigenadas. La fragmentación es muy escasa (ruptura de algunos enlaces C-0 en xantofilas) o totalmente nula, por lo que esta técnica es extremadamente útil en la determinación de pesos moleculares de estos pigmentos. Se pueden conseguir fragmentaciones mayores, y en muchos casos muy significativas, empleando espectrometría de masas en tándem (MS-MS), según describen Van Breemen et al. (1995). Los límites de detección de esta técnica oscilan entre los 9 y los 28 pmol, dependiendo de la naturaleza del pigmentos.

Las conclusiones se hicieron conforme se respondía a un objetivo.

Pueden revisar los trabajos, todos están en linea y son de libre acceso.

Espero que de verdad le guste este articulo y pues estaré subiendo otros de los proyectos estudiantiles que he hecho y creo que son interesante.
Genial tu post y bastante comprensible. Muy útil como referencia.
Me encanto tu trabajo, muy interesante!
Gracias, solo quería compartir un poco del trabajo que hago en la universidad con esta comunidad, ya que adoro mi carrera y la encuentro super interesante.
Congratulations @fujoshi94! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on any badge to view your own Board of Honor on SteemitBoard.
For more information about SteemitBoard, click here
If you no longer want to receive notifications, reply to this comment with the word
STOP