Solubilidad de los precipitados y los factores que pueden modificarla
¡Hola comunidad de steemit! Saludos y feliz año 2019.
En nuestra vida cotidiana hemos observado como hay sustancias que son muy solubles en agua como por ejemplo, el azúcar, la sal de mesa, el vinagre, el bicarbonato de sodio entre otros. Dicha propiedad es la que permite emplearlos con frecuencia con fines culinarios y domésticos. Lo que ocurre a nivel molecular, en estos casos, es que cuando se añade por ejemplo, azúcar al agua, las moléculas de agua se aproximan a la superficie del cristal, se forman los enlaces de hidrógeno entre las moléculas del agua y azúcar. Las moléculas del azúcar que se encuentran en la superficie del cristal son atraídas a la solución por las moléculas del agua pero a la vez son retenidas por otras moléculas del azúcar. Cuando las moléculas del agua logran separarlas del cristal se disuelven en el solvente, rodeadas por moléculas de agua.
Sin embargo, existen otras sustancias que presentan muy baja solubilidad en el agua, se disuelven en una pequeña proporción, pero al modificar ciertos factores puede que la solubilidad cambie.
Un ejemplo, es el CaCO3 (carbonato de calcio), polvo blanco conocido como caliza o tiza, muy abundante en la naturaleza.

Figura 1. Carbonato de calcio. Fuente: @yusvelasquez.
Cuando este polvo se añade en agua y se agita, se observa que solo una pequeña cantidad se disuelve, la mayor parte permanece sin disolverse. Sin embargo, la cantidad que se disuelve se disocia en su totalidad, expresada por la siguiente reacción:
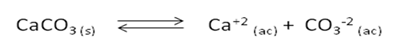
La constante del producto de solubilidad (Kps) para esta sal, viene dada por:
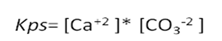
Cuyo valor es de 4,8x10-9 a 25 °C[1], lo que significa que a esta temperatura solo se disuelven 6,92x10-3 g en 1 L de agua, por más que se añada sal al agua solo se podrá disolver dicha cantidad.
La importancia del estudio de este tipo de compuestos es su tendencia a formar precipitados (sólidos de muy baja solubilidad). Una de las aplicaciones del conocimiento de las propiedades de las sales poco solubles es la determinación de las sustancias presentes en una muestra. Por ejemplo, si se desea determinar el contenido de cloruro en agua de mar; se puede adicionar nitrato de plata a la muestra para formar el cloruro de plata, de muy baja solubilidad que posteriormente se podrá separar de la mezcla de reacción por filtración y la cantidad de sustancia presente se determina por medio de la masa aplicando el método gravimétrico. En este método se adiciona un exceso de agente precipitante aportando un ion común garantizando así que la mayor parte de cloruro precipite. Así mismo, existen una gran cantidad de compuestos que pueden determinar mediante la precipitación.
Factores que afectan la solubilidad de los precipitados
Existen varios factores que pueden variar la solubilidad de un compuesto poco soluble.
Adición de un electrólito fuerte
Supongamos que a una solución que contiene CaCO3 se le adiciona un electrólito fuerte como el cloruro de sodio (NaCl) o sal de mesa. En este caso las reacciones involucradas son:
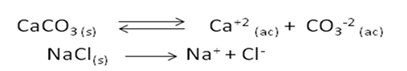
Al agitar vigorosamente y disolver la sal adicionada se podrá observar que la solubilidad del carbonato aumenta, tal como se muestra en la siguiente imagen.
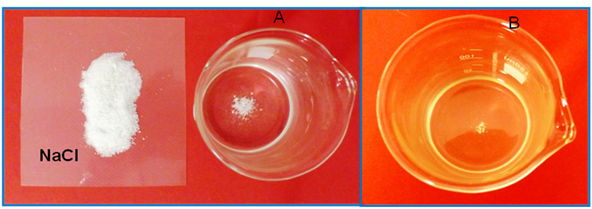
Figura 2: A. Solución saturada de CaCO3, B. Solución de CaCO3 después de adicionar NaCl. Fuente: @yusvelasquez.
Este aumento de la solubilidad del carbonato se debe a la fuerza de atracción electrostática entre los iones del NaCl y los iones que participan en el equilibrio del CaCO3, ya que estos últimos se ven rodeados por los iones de carga opuesta del electrolito, provocando así que los iones Ca+2 sean un poco menos positivos y los iones CO3-2 un poco menos negativos de lo que serían en ausencia del electrólito fuerte, disminuyendo la atracción global entre los iones del CaCO3 y desplazando el equilibrio hacia la derecha, aumentando así la solubilidad.
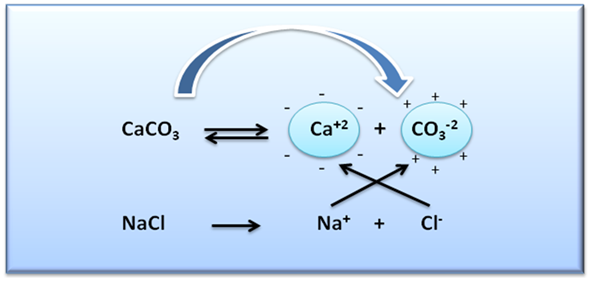
Figura 3: Efecto de la adición de NaCl sobre la solubilidad del CaCO3. Fuente: @yusvelasquez.
Adición de un ion común
Cuando se agrega por ejemplo, CaCl2 a una solución saturada de CaCO3 se obtiene el siguiente resultado:
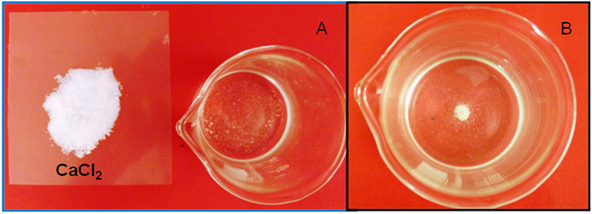
Figura 4: A. Solución saturada de CaCO3; B. Solución de CaCO3 después de adicionar CaCl2. Fuente: @yusvelasquez.
Como se puede observar, disminuye la solubilidad del carbonato. Esta disminución se debe a que al adicionar un compuesto que aporte un ion común a la sal, en este caso el ion Ca+2, el producto iónico aumenta siendo mayor al valor de Kps del CaCO3, por lo que la reacción de disolución de la sal se desplaza hacia la izquierda contrarrestando el exceso del ion, lo que hace que disminuya la solubilidad, tal como lo establece el principio de Le Chatelier, para que se restablezca el equilibrio, algo de CaCO3 precipitará, hasta que el producto iónico se haga otra vez igual al Kps.
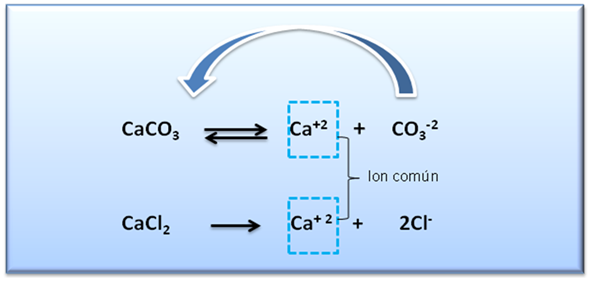
Figura 5: Efecto de la adición de CaCl2 sobre la solubilidad del CaCO3. Fuente: @yusvelasquez.
pH
Este factor tiene influencia en aquellos compuestos que contienen un anión que es la base conjugada de un ácido débil, tal es el caso del CaCO3, ya que el ion CO3-2 es la base conjugada del H2CO3.
Al trabajar con pH bajos, la solubilidad de la sal aumenta tal como se muestra en la imagen siguiente:
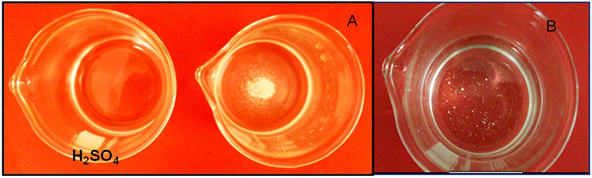
Figura 6: A. Solución saturada de CaCO3; B. Solución de CaCO3 después de adicionar H2SO4. Fuente: @yusvelasquez.
Esto se debe a que el ion CO3-2 se combina con el H+ proveniente en este caso del H2SO4 dando origen a otros equilibrios hasta la formación del ácido débil, lo que ocasiona que el equilibrio se desplace hacia la derecha aumentando la solubilidad del CaCO3.
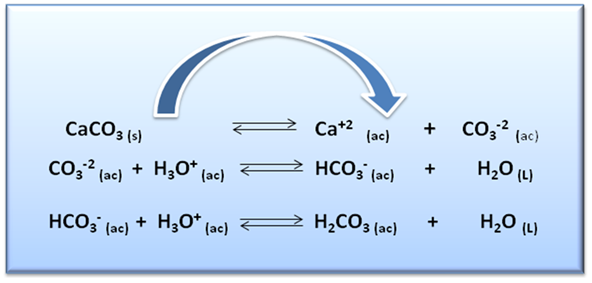
Figura 7: Efecto de la adición de H2SO4 sobre la solubilidad del CaCO3. Fuente: @yusvelasquez.
Temperatura
En este caso, se puede observar en la siguiente figura que al aumentar la temperatura de una solución saturada en CaCO3 aumenta la solubilidad, este comportamiento ocurre en la mayoría de los compuestos iónicos y moleculares ya que se disuelven en procesos endotérmicos donde la absorción de calor favorece la disolución.
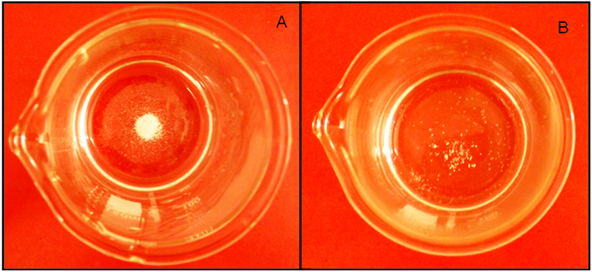
Figura 8: A. Solución saturada de CaCO3, B. Solubilidad del CaCO3 al aumentar la temperatura. Fuente: @yusvelasquez.
Es así como en un análisis químico, es posible variar cualquiera de estos factores dependiendo del objetivo que se persiga y lo que se desee separar y cuantificar.
¡Hasta aquí la información relacionada con la solubilidad de los precipitados. Espero sea de gran utilidad la información presentada!. ¡ Hasta un próximo post!
Referencias Bibliográficas
[1]. Whitten, K. (1985). Química General
[2]. Skoog W., Holler C. Química analítica. 7ma edición
[3]. Harvey, D. (2002). Química Analítica Moderna.
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Congratulations @yusvelasquez! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board
If you no longer want to receive notifications, reply to this comment with the word
STOPSaludos @yusvelasquez. Muy buena información, conocer los factores que influyen en la solubilidad de las sustancias es muy importante para controlar su efecto sobre algunos procesos, por ejemplo, controlar la solubilidad de sales como el carbonato de calcio es muy importante para la protección de líneas de procesos donde ocurre intercambio de calor, ya que los depósitos de carbonatos forman incrustaciones que obstruyen las tuberías y reducen el rendimiento de los equipos.
Hola @yusvelasquez, un aporte muy educativo el que compartes con la comunidad, con el mismo dejas en evidencia de que en el quehacer cotidiano de los seres humanos generalmente estamos obteniendo soluciones a partir de la combinación de diferentes solutos y solventes sin tener conocimiento de que se trata de un saber científico propiamente de la Química que estamos aplicando, asimismo destacas al agua o H2O como solvente universal. También es muy interesante para los que no somos de tu área conocer de forma detallada y sencilla los factores involucrados en el proceso de obtención de soluciones. En general, muy agradable la lectura y buen referente para estudiantes de Química, saludos cordiales!!
Hello @yusvelasquez! This is a friendly reminder that you have 3000 Partiko Points unclaimed in your Partiko account!
Partiko is a fast and beautiful mobile app for Steem, and it’s the most popular Steem mobile app out there! Download Partiko using the link below and login using SteemConnect to claim your 3000 Partiko points! You can easily convert them into Steem token!
https://partiko.app/referral/partiko
Congratulations @yusvelasquez! You received a personal award!
Click here to view your Board
Do not miss the last post from @steemitboard:
Vote for @Steemitboard as a witness and get one more award and increased upvotes!