Fundamentos de Bioquímica / “Estructura de los compuestos biológicos según la teoría del Orbital Molecular”
Distinguido lector, respetando el objetivo principal de presentar el aprendizaje sobre bioquímica, desde sus fundamentos hasta llegar a exponer los componentes moleculares y su metabolismo; en esta oportunidad se les presenta: la estructura de los compuestos biológicos según la teoría del Orbital Molecular, lo cual ha sido elaborado con la finalidad de aportar conocimientos básicos sobre los procesos bioquímicos que rigen en la vida natural del ser humano a nivel celular y molecular, facilitando la comprensión de los mismos.

¿Qué es la Estructura Atómica?
“…Es la manera en que está distribuida cada una de las partículas que forman a un átomo. Ya sabemos que protones y neutrones están unidos formando un núcleo en el centro del átomo... Y que los electrones se encuentran girando en torno al núcleo en los llamados orbitales atómicos. Así entonces la estructura de un átomo consiste en un núcleo cargado positivamente y alrededor de este núcleo están los electrones cargados negativamente…” ✱
Según Daltón, “cada elemento está formado por átomo del mismo tipo”; cada átomo representa la porción más pequeña e indivisible del elemento y posee todas las propiedades del mismo.
A finales del siglo XIX, ya se sabía que los átomos no eran partículas simples e individuales, sino que estaban constituidos por una serie de pequeñas partículas denominadas elementales, las cuales son comunes a todos los átomos, y lo que diferenciaba los átomos de un elemento de los demás, era la cantidad y proporción de las partículas que lo formaban. Entre las principales partículas elementales descubiertas se encontraron:
- El Electrón, con carga negativa y casi sin masa
- El Protón, con carga positiva y masa
- El Neutrón, sin carga y con masa
En la actualidad el número de partículas subatómicas descubiertas es mayor de 100, lo cual nos da la idea de la complejidad de las estructuras atómicas.
Modelos Atómicos
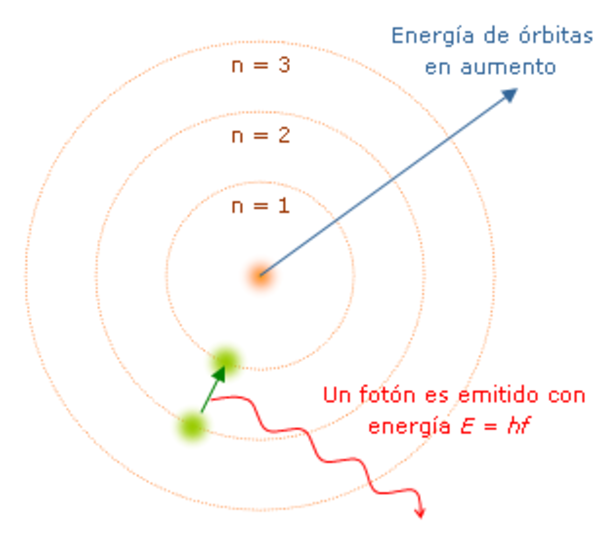
El modelo atómico más sencillo es el enunciado por Ernest Rutherford en 1911, quién llevó a cabo un experimento para comprobar la verdad del modelo de Thomson. Este experimento consiguió en investigar la dispersión de las partículas alfa al atravesar delgadas placas metálicas, el 99% de las partículas alfas pasaron en línea recta, pero algunas se desviaron formando ángulos bastante grandes, y un número muy reducido se reflejaron y retrocedieron en sus trayectorias. Para Rutherford el resultado fue asombroso; estas fueron sus propias palabras:
“...era casi tan increíble como si alguien disparase una granada de 15 pulgadas contra un trozo de papel de seda, fuese rechazada y golpease al lanzador...”
El modelo de Thompson no era capaz de explicar tan grandes desviaciones. Según este modelo, el átomo está formado por un núcleo, donde se concentra toda la masa y carga positiva (neutrones y protones), y una corteza, donde se localizan los electrones, que giran a grandes distancias con una velocidad tal, que su fuerza centrífuga compensa la fuerza electrostática de atracción ejercida por el núcleo.
Los átomos de cada elemento poseen un número característico de electrones, protones y neutrones en su corteza y el núcleo. Los conocimientos actuales indican que el átomo no es tan sencillo como el modelo presentado por Rutherford y Bohr. Los estudios de la mecánica cuántica han reducido a la conclusión de que los electrones no pueden localizase en una trayectoria fija. Las trayectorias definidas del modelo atómico de Rutherford y Bohr deben sustituirse por regiones del espacio donde exista una gran probabilidad de que se encuentre el electrón.
Orbitales Atómicos
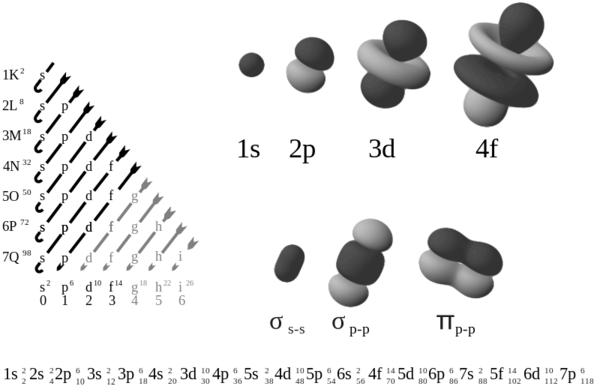
Un orbital atómico es una región del espacio en torno al núcleo, en la cual existe una alta probabilidad de encontrarse un electrón. En cada orbital atómico pueden situarse dos electrones. Los orbitales atómicos más sencillos son los orbitales 's', que poseen simetría esférica. Los orbitales 'p', que poseen dos lóbulos a lo largo de un eje. Según el orden cartesiano que sigan se denominan: Px, Py y Pz. Los orbitales atómicos 'd' y 'f', son más complejos.
Los electrones situados en cada orbital poseen un contenido energético característico que se designa por:
- El nivel de energía principal número cuántico n, relacionado con el tamaño del orbital.
- El subnivel s, p, d, f ó g, relacionado con la forma del orbital.
- Excepto s, cada subnivel tiene algún número de orbitales de igual energía (degeneración) que difieren en su orientación espacial.
- El spin designado por s
En el orbital p no hay oportunidad de hallar un electrón en el núcleo (el núcleo se denomina punto nodal). Las regiones de un orbital que están separadas por un punto nodal recibe los signos “+” y “-”, estos signos no están asociados con cargas eléctricas o iónicas. En orbitales se utilizan tres principios:
- Principios “Aufbau” o de construcción. Los orbitales se llenan siguiendo un orden creciente de energía: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p.
- Principio de exclusión de Pauli. No más de dos electrones pueden ocupar un orbital y sólo entonces si tiene spins opuestos.
- Reglas de Hund. Un electrón está colocado en cada orbital de igual energía, de modo que los electrones tienen spins paralelos, antes de que ocurra apareamiento (las sustancias con electrones no apareados son paramagnéticos: son atraídas a un campo magnético).
Teoría de los Orbitales Moleculares (TOM)
“… es un método para determinar el enlace químico en el que los electrones no están asignados a enlaces individuales entre átomos, sino que se mueven bajo la influencia de los núcleos de toda la molécula…” ✱
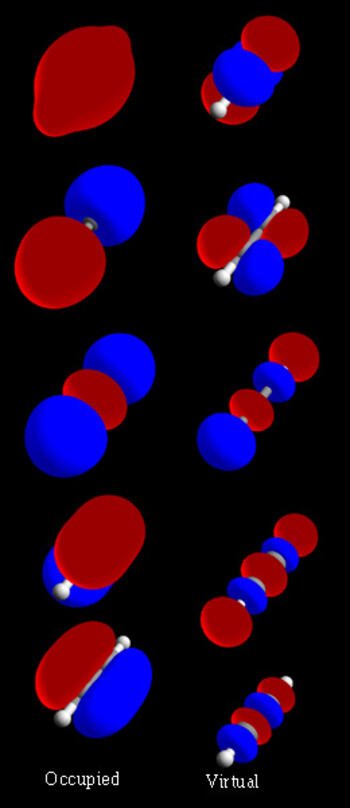
El orbital molecular se produce por la superposición de dos orbitales atómicos. La interacción de dos orbitales atómicos en realidad crea dos orbitales moleculares. Sí los orbitales con signos semejantes se superponen, resulta un orbital molecular enlazante, el cual tiene una alta densidad eléctrica entre los átomos y en consecuencia una energía menor (mayor estabilidad) que la de los orbitales atómicos individuales. Sí los orbitales atómicos de diferente signos se superponen, resulta un orbital molecular antienlazante, el cual tiene un nodo (ninguna densidad electrónica entre los átomos) y por consiguiente, tiene una energía mayor que la de los orbitales atómicos individuales.
La superposición cabeza a cabeza de los orbitales atómicos da un orbital molecular sigma (r) (los enlaces se denominan enlace sigma). El orbital molecular antienlazante correspondiente se designa como r.
La línea imaginaria que une los núcleos de los átomos enlazantes es el eje de enlace, cuya longitud es la longitud de enlace.
Enlace Covalente
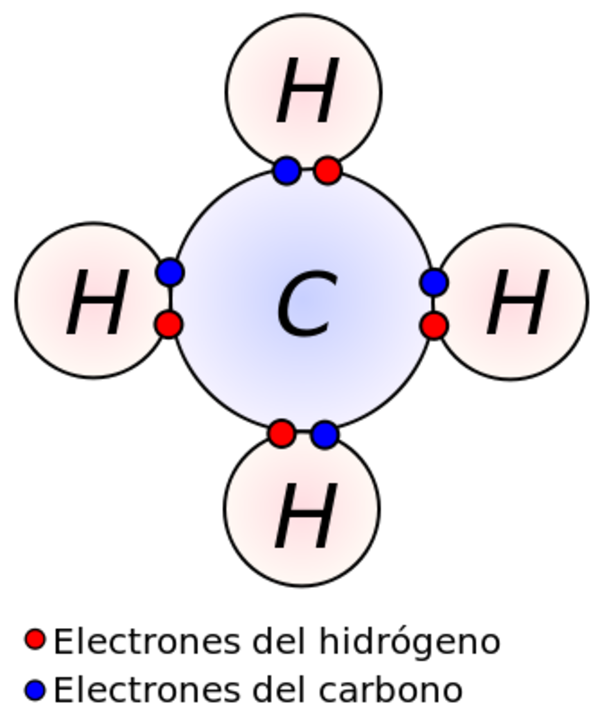
El enlace covalente se forma por el compartir los electrones entre los átomos son electronegatividad semejante. La formación de enlace covalente en los compuestos se observa con claridad en las estructuras de Lewis, las cuales están formadas por el símbolo de los elementos rodeados de puntos. El número de puntos indica los electrones existentes en la órbita exterior del átomo. Lewis supuso que el enlace covalente se forma por una comparación de electrones entre los átomos, al tener éstos tendencia a adquirir la configuración de los gases nobles. Así la molécula de cloro se formaría por la compartición de los electrones de la capa externa de la siguiente forma: CL CL, sin embargo, se han encontrado moléculas como el NO y el No2 con enlaces covalentes, igualmente tenemos los compuestos como el CL5P que contiene átomos con el P, que se rodea con 10 electrones, configuración que no corresponde a ningún gas noble. De las teorías de Lewis ha perdurado la noción de la compartición de electrones, y se ha desechado la de la tendencia a adquirir la configuración de gas noble y la que sostiene que la suma de los electrones de las capas externas de los átomos que forman la molécula es par. Después de Lewis, la mecánica cuántica ha proporcionado dos métodos de estudio del enlace covalente; uno de ellos es la teoría de orbitales moleculares. Según esta teoría, los orbitales atómicos se superponen para formar un nuevo tipo de orbital, son los orbitales moleculares que dan lugar a la molécula.
La unión covalente se produce entre electrones desaparecidos (solo en una orbital), pudiendo un átomo formar tantos enlaces como electrones desapareados tenga. Este número determina la valencia covalente de ese elemento. El grado de desapareamiento puede ser máximo siempre que los electrones no cambien de nivel energético.
El enlace covalente es muy importante en los medios biológicos. La unión de la molécula de bajo peso molecular que dan lugar a las macromoléculas biológicas (ácidos nucleicos, proteínas polisacáridos y líquidos complejos) esta está mantenida mediante enlaces covalentes.
El enlace covalente coordinado se caracteriza por compartición de electrones, en el que uno de los átomos aporta el par de electrones y el otro el orbital vacío.
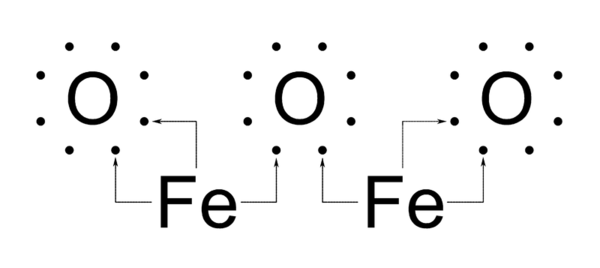
En los sistemas biológicos los enlaces de coordinación más frecuentes son los que se establecen entre átomos metálicos (con orbitales vacíos) y pares electrónicos de otros átomos, (fundamentalmente nitrógeno), como en el grupo hemos de la hemoglobina donde el hierro se une mediante enlaces coordinación a átomos de nitrógeno del anillo periférico.
Orbitales Híbridos

No siempre el enlace entre los átomos para formar las moléculas se efectúa a través de la unión de orbitales atómicos puros. Muchos experimentos han señalado que la unión de diferentes átomos para formar moléculas, se realiza por intermedio de orbiles provenientes de la mezcla de orbitales atómicos, cuyos orbitales resultantes se denominan orbitales híbridos y el proceso se llama hibridación.
Un átomo de carbono puede dar cuatro orbitales atómicos de igual energía para formar cuatro enlaces sigma equivalentes como en el metano, CH4. Se considera que los cuatro orbitales atómicos equivalentes se forman al combinar los 2s y los tres orbitales 2p, esta combinación es una hibridación. La repulsión entre pares de electrones hace que estos orbitales híbridos tengan los ángulos de enlace máximos. Los orbitales híbridos sp y sp2 tienen forma de nubes.
Con todo este orden de ideas, conceptos y explicaciones, se puede establecer, claramente, la distribución de electrones en los orbitales atómicos del carbono y el oxígeno; además, se expuso la diferencia del átomo ante los demás elementos, mostrando que la diferencia es la cantidad y proporción de las partículas que lo forman. También, sugiere la diferencia entre un orbital atómico y un orbital molecular, en donde el orbital atómico es una región del espacio en torno al núcleo, en la cual existe una alta probabilidad de encontrar un electrón, mientras que el orbital molecular, se produce por la superposición de dos orbitales atómicos. Y se explica la importancia del porque el experimento de Rutherford obligó a rechazar el modelo atómico de Thompson; ya que, el modelo atómico de Rutherford, consistió en investigar la dispersión de las partículas alfa al atravesar delgadas láminas metálicas. El 99% de las partículas alfas pasaron en línea recta, unas se desviaron en ángulos bastantes grandes, y un número muy reducido se reflejaron y reprodujeron en sus trayectorias. Así, el experimento de Rutherford obligó a rechazar el modelo atómico de Thompson, debido a que no era capaz de explicar tan grandes desviaciones como lo hizo el módulo de Rutherford.
Expuesto todo lo anterior, el apreciado lector, deberá sacar sus propias conclusiones.
Vertale bien @wayuu-reg mis felicitaciones. buena recopilación de los orbitales atómicos.
Apareció el señor @joseg ¡saludos!
Hola @joseg
Te envío un granito de apoyo para que vuelvas a publicar. Saludos!
Ok gracias, aunque si me delega unos 10 steem, no me cae nada mal.
¡Ponte a trabajar!
ja ja ja
Soy maestra integral, y me gusta leer este tipo de información. Es el conocimiento básico en la cátedra inicial de bioquímica, y acompañada de todas esas imágenes, se presenta como una excelente publicación ¡bastante completa!
Felicitaciones @wayuu-reg
Me siento que regrese al liceo! 😮🧠💯
Que bien!
yo no entiendo mucho de este tema, pero lo que si puedo ver es que te destacaste muchisimo buscando informacion y lograste un buen post, tiene un buen maquetado con imágenes y más.
Muchas gracias por su comentario
Un millon de gracias por compartir esto y espero sigas enseñando!
Gracias @drawing4life
Es usted muy amable
Congratulations @wayuu-reg! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
You can view your badges on your Steem Board and compare to others on the Steem Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPTo support your work, I also upvoted your post!
Vote for @Steemitboard as a witness to get one more award and increased upvotes!
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Please consider setting @steemstem as a beneficiary to your post to get a stronger support.
Please consider using the steemstem.io app to get a stronger support.