Hibridación de orbitales atómicos. Hibridación tipo sp2
Saludos estimados lectores.
En esta ocasión quiero dar continuidad al tema de la hibridación de orbitales atómicos, como en la vez anterior les comenté, existen moléculas en las cuales se presenta el problema de explicar cómo se pueden formar enlaces idénticos partiendo de orbitales atómicos diferentes, la explicación también viene dada por el proceso de hibridación, es decir, por la recombinación de orbitales puros en nuevos orbitales híbridos, que son idénticos energéticamente, diferenciándose solo por su orientación espacial. En la publicación anterior comentamos las características de la hibridación sp3, pero no es el único tipo, así que abarquemos los otros tipos de orbitales híbridos, siguiendo con el sp2.
¡Comencemos!
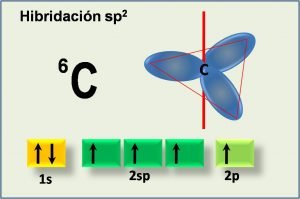
Hibridación sp2
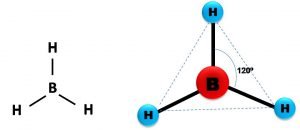
Cuando en un átomo se combinan un orbital s con dos orbitales p, manteniéndose inalterado uno de los orbitales p (recuerden que son tres), se genera lo que se denomina orbitales híbridos sp2. Tomemos como ejemplo la molécula de borano (BH3); al tener el boro como número atómico Z=5, su configuración electrónica es:
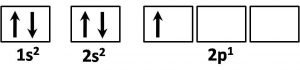
Como ya hemos planteado antes, al tener un solo electrón desapareado en los orbitales p se esperaría que solo pudiese formar un solo enlace; sin embargo, ya que los orbitales 2s y 2p tienen un niveles energéticos similares, no resulta difícil que un electrón de los situados en 2s pase a ocupar uno de los orbitales 2p vacios, incluso para evitar la repulsión provocada por estar dos electrones en el mismo orbital, y de este modo se produce la homogenización de un orbital s con dos orbitales p, produciendo tres orbitales híbridos sp2, y quedando un orbital p vacio.
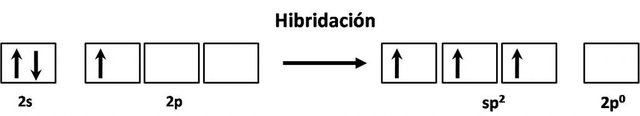
Un átomo con hibridación sp2 adopta una forma trigonal, esto es, los orbitales híbridos se ubican en el mismo plano espaciados por un ángulo de 120º.
Ahora bien, ¿Qué papel juega el otro orbital p?
Este es capaz de formar un doble enlace, mientras que los orbitales híbridos permiten la formación de tres enlaces sencillos. Vemos otro compuesto del carbono, la molécula del etileno (C2H4), cuya estructura de Lewis se representa de la siguiente forma:
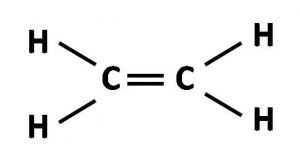
Como el átomo de carbono tiene un número atómico igual a 6, para formar la molécula de etileno su hibridación quedaría como:
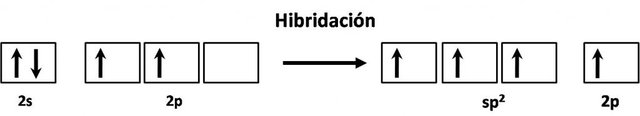
El átomo con esta configuración se visualizaría como un plano con tres regiones de densidad electrónica alrededor del átomo de carbono, atravesadas de forma perpendicular por el orbital p puro. Los orbitales híbridos sp2 forman enlaces σ mientras que el orbital p puro forma un enlace π (un enlace π implica un doble enlace).
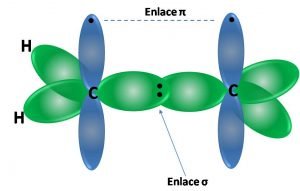
En la figura anterior se representa la estructura de la molécula de etileno. Como se puede observar, gracias a este tipo de hibridación todos los átomos de la molécula se pueden situar en el mismo plano, mientras que el orbital p puro se ubica de forma perpendicular a la molécula y paralelos entre sí, lo que permite la formación del enlace π, lo que también le aporta estabilidad a la molécula.
Esta hibridación es típica de los compuestos de carbono unidos a otros tres átomos y a uno de ellos mediante un doble enlace, como en el caso de los alquenos. Bueno amigos, hasta aquí la presente publicación, luego continuaremos avanzando con otro tipo de hibridación para completar los tipos posibles de sp, ¡hasta entonces! 
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/09/hibridacion-de-orbitales-atomicos-hibridacion-tipo-sp2
De esta forma la molécula de etileno adquiere una estructura plana con ángulos de enlace de aproximadamente 120º.

Referencias
Wikipedia. Hibridación
La guía de química. Hibridación
Quimitube.com. Modelo del enlace de valencia.Hibridación sp2 con enlaces simples.
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/09/hibridacion-de-orbitales-atomicos-hibridacion-tipo-sp2
Muy buena explicación de la hibridación de orbitales sp, saludos @emiliomoron
Saludos @yekamendez. Muchas gracias, me alegra que te haya gustado
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPTo support your work, I also upvoted your post!
Se nota que es un post elaborado con dedicación y esmero, felicitaciones.
Muchas gracias por tu comentario @ivymalifred, me alegra que te gustara y que pasaras por mi blog a leer. Saludos!!
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOP