Celdas electrolíticas. Partes y como funciona
Saludos amigos de steemit y estimados lectores.
Las celdas electrolíticas constituyen un medio en el cual la energía eléctrica aplicada fuerza a que se produzcan reacciones de óxido-reducción que de otro modo no se llevarían a cabo, es decir, que no son espontáneas. Y el proceso mediante el cual una sustancia se descompone por acción de la corriente eléctrica se conoce como electrólisis. Termino que se deriva del de la palabra griega lisis que significa romper, liberar.
¡Quédense a conocer sus partes y cómo funcionan!
Las celdas electrolíticas están compuestas por un recipiente donde se sumergen dos electrodos en una solución en la que se encentran disueltos iones, y estos están conectados a una fuente de corriente continua.
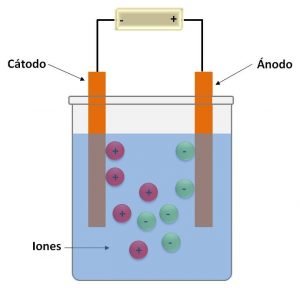
Los electrodos son elementos metálicos que proporcionan la superficie de contacto entre la solución y el conductor eléctrico y en los que se producen las reacciones de oxidación y reducción. El cátodo es el electrodo donde se da lugar a la reacción de reducción, es decir, donde las especies químicas ganan electrones; este posee carga negativa, y por ende, a él migran los iones con carga positiva. Mientras que el ánodo es el que se produce la reacción de oxidación, este es el que posee entonces carga positiva y a él migran los iones con carga negativa. Cuando los electrodos no intervienen en dichas reacciones (es decir, ni se oxidan ni se reducen) estos son llamados electrodos inertes o pasivos, y cuando participan se les denomina electrodos activos.
Fuente: elaboración propia

Bueno amigos, espero haber aportado información de utilidad, ¡hasta la próxima!

Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/11/celdas-electroliticas-partes-y-como-funciona
Cuando se aplica el voltaje a los electrodos al cerrar el circuito, los iones disueltos en la solución son atraídos al electrodo con la carga opuesta a este. Cuando el voltaje aplicado es suficiente y con la polaridad correcta, entonces se puede producir la descomposición de un compuesto químico estable.
Diferencia entre celda electrolítica y celda galvánica
En las celdas galvánicas por el contrario, se convierte la energía química de una sustancia en energía eléctrica, mediante el uso de reacciones que si son espontaneas y que pueden tener lugar en los electrodos. En las celdas galvánicas entonces, el voltaje es debido a la liberación de energía producto de la transferencia de electrones desde un electrodo al otro. Una celda galvánica de forma simple está constituida entonces de la celda, llena con la solución que aporta los electrolitos y dos electrodos diferentes. También se pueden configurar como dos medias celdas, donde se ubica un electrodo en cada una, las cuales se interconectan mediante un puente de intercambio de iones, que por lo general es una solución salina.
Electrólisis del agua
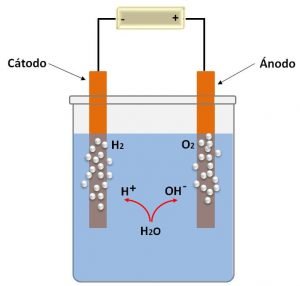
Cuando en un recipiente con agua (a la cual se le adiciona un electrólito para mejorar su conductividad) se introducen dos electrodos inertes conectados a una fuente de energía, se produce la descomposición electrolítica del agua en hidrógeno y oxígeno.

Producto de la autoionización del agua se generan iones H+ y OH-. Los iones H+ se movilizan al cátodo donde se reducen a H2, y los iones OH- se movilizan al ánodo donde se oxidan a O2, observando el desprendimiento de los gases. Las reacciones implicadas son:

De acuerdo a esta expresión, se requiere de una fuerza electromotriz de por lo menos -1,23 V para lograr la reacción, aunque en la práctica no suele ser menor de 2 V para poder vencer la resistencia que oponen los iones a aproximarse a los electrodos. Aunque por medio de esta forma se puede obtener hidrógeno y oxígeno gaseoso, el consumo de energía solo hace de esta técnica viable para fines muy específicos.
Otras aplicaciones importantes de las celdas electrolíticas son la purificación de metales, la electrolisis de compuestos fundidos es el procedimiento más usado para obtener metales de los grupos IA y IIA de la tabla periódica. El cloro puede obtenerse de forma más económica por medio de la electrolisis del cloruro de sodio disuelto.

Referencias
Chang, R. Química general. Editorial Mc-Graw Gill.
Whiten, K.W., Gailey, K.D. Química general. Editorial Interamericana.
[Wikipedia.com. Célula electrolítica](https://es.wikipedia.org/wiki/C%C3%A9lula_electrol%C3%ADtica
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2018/11/celdas-electroliticas-partes-y-como-funciona
Muy buena descripción y diferenciación de las celdas, en algunas ocasiones he montado prácticas de laboratorio con este tema para estudiantes de cuarto año de bachillerato. saludos amigo @emiliomoron
Gracias por tu comentario @yekamendez, estas celdas son muy prácticas para hacer demostraciones muy visuales para los estudiantes que se inician en el estudio de la química. Saludos amiga!
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Congratulations @emiliomoron! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Te invitamos a disfrutar del más rápido servicio exchange y con las mejores tasas de todo el Mercado. Cambiamos tus SBD a BsS rápido y sencillo. Pásate por nuestro servidor y compruébalo tu mismo: https://discord.gg/84pJNb3
@emiliomoron