Science for Everybody #8: Soap and detergents / Wissenschaft im Alltag #8: Seife und Waschmittel

Hi Steemians,
welcome to the next part of my series “Science for Everybody”! Today’s topic is based on a suggestion by @elainetheinsane – thank you for that!
Today’s topic
In this post, we take a closer look on the topic “soap and detergents”. It should be a topic to which everyone of us had minimum indirect contact with. :-)
Water and dirt
How do detergents and soap work? To understand this, we need to know how dirt (let’s take for example fat/oil) differs from water (which we normally use to wash). Therefore, we need to look again at the structure of the particles.
The water molecule
We saw already in the chapter about the microwave oven that the water molecule is a dipole molecule, thus meaning it has two sides with a different charge (more precise: with different partial charge).
Fats
Contrary to water, fats are mostly or completely nonpolar substances. The fats that we usually use are compounds consisting of glycerin and so called fatty acids. These are molecules that mainly consist of a long chain of carbon atoms with hydrogen atoms on each carbon. The electrons are equally distributed over the molecule because carbon and hydrogen have a similar electronegativity. Therefore, the molecule is not polar.
Many substances that we know for example as dirt in our clothes are more or less nonpolar hydrocarbons.
Miscibility of fat and water
All of us knows that water and fat aren’t miscible (we see it for example in the kitchen – you may think about a vinaigrette or drop of grease on a soup). The reason for this is, that the polar water molecules want to stay amongst themselves and so do the nonpolar fat molecules. If you mix a vinaigrette rapidly, you get a mixture (more precise an emulsion) for a short time which separates over time. In general, there is the principle ” like dissolves like” - therefore, e.g. salt (which consists of charged ions) dissolves good in water but not in oil.
Soap – mediator between two worlds
Soap is a special case of the so-called surfactants (or tensides). Maybe you have read about anionic surfactants or cationic surfactants on the ingredient list of a rinsing agent. In general, these are substances that are miscible with polar as well as non-polar substances. Therefore, they can “mediate” between them.
They are able to do this because they have a nonpolar side and a polar group on one end – you can imagine the structure like a match with its stick and the little head.

Source
The both sides are called lipophilic/hydrophobic on the one hand, which means fat loving/water hating and lipophobic/hydrophilic on the other hand, meaning fat hating/water loving. The head of the match is usually an ionic (charged) group and has therefore a negative (anionic) or positive (cationic) charge. Besides this, there are polar groups possible, that are not ionic (like water is a polar but not ionic molecule). Finally, there are surfactants with both an anionic and a cationic group. These are called amphoteric or dipolar ionic.
An example for these molecules are the above mentioned fatty acids. If they are not bound to glycerin, they have a nonpolar lipophilic part (the carbon chain). The acidic group is negatively charged in water and therefore hydrophilic. Soap consists of such fatty acids which are gained from fats. The separation of the fats in acid and glycerin is called saponification.
How surfactants work
If we add a surfactant to water, the following happens: the hydrophilic part (the head) is very comfortable but the lipophilic part wants to get away from the water. If the amount of surfactant is small, the molecules accumulate at the surface and they put the sticks to the air above.
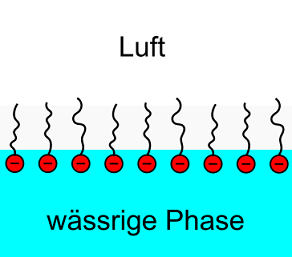
Source
If the surface is completely covered and there are still further molecules, the form so-called micelles. In principle, these are little spheres where the sticks of the surfactants are on the inside amongst themselves and the heads are on the surface to shield them.
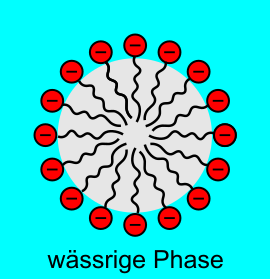
Quelle
If we added the surfactants to a bowl with oil, the same would happen but the molecules are ordered the inverse way.
If the other liquid is added to our mixture (most of the time oil to soap water), it does not swim on the surface but is clustered around by the surfactants with their lipophilic side. At the latest now, micelles are forming which embed the fat inside. Because the hydrophilic heads are on the outside, the oil droplets can be dispersed well in the water and then be flushed away.
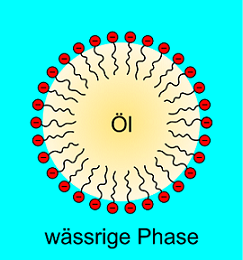
Source
Further ingredients and features of laundry detergents
The basic principle – “catching” hydrophobic substances like fats and wash them out – is the same for laundry detergents. However, they consist not only of surfactants.
Besides the mediators, there are for example fragrances, colorants or preservatives. Laundry detergents may also contain bleacher or enzymes. These are biochemical substances which allow certain reactions. In the laundry detergent, they can arrange for decomposing certain substances. These can be for example stains of food on our clothes, dander or natural colorants. Furthermore, there are special ingredients that should prevent the marking off of clothes.
Terminating for now
I hope that I was able to show you the basic principle behind the washing with soap. Every product has surely its very own composition which is optimized for certain applications by the producer. However, all products contain some surfactants to remove common contaminations. If you want to read more, I link the Wikipedia articles as a further information. Like always, we could get deeper into the matter but this is not the aim of this series.
See you next time!
Further information
Surfactants
Soap
Laundry detergents
Hallo Steemianer,
willkommen zum nächsten Teil meiner Serie Wissenschaft im Alltag! Das Thema des Tages verdanken wir einem Vorschlag von @elainetheinsane – vielen Dank dafür!
Heutiges Thema
In diesem Beitrag wollen wir uns das Thema „Seife und Waschmittel“ mal etwas genauer anschauen. Das sollte ein Thema sein, das jeden von uns zumindest indirekt schon einmal beschäftigt hat :-)
Wasser und Schmutz
Um die Funktionsweise von Waschmitteln und Seife zu verstehen, sollten wir uns zunächst einmal anschauen, was Schmutz (nehmen wir als Beispiel mal Fette/Öle) von Wasser (mit dem wir ja normalerweise waschen) unterscheidet. Dazu müssen wir nochmal ein bisschen nach dem Aufbau der jeweiligen Teilchen schauen.
Das Wassermolekül
Wie wir im Kapitel über die Funktionsweise der Mikrowelle bereits gesehen haben, ist das Wassermolekül ein Dipol, es hat also zwei unterschiedlich geladene (genauer partial-/teilgeladene) Seiten.
Fette
Im Gegensatz zum Wasser sind Fette größtenteils oder vollständig unpolare Substanzen. Es handelt sich bei den Fetten, die wir üblicherweise verwenden, um Verbindungen aus Glycerin und sogenannten Fettsäuren. Dies sind Moleküle, die im Wesentlichen aus einer langen Kette aus Kohlenstoffatomen bestehen, wobei an jedem Atom noch Wasserstoffatome sitzen. Da Kohlenstoff und Wasserstoff eine ähnliche Elektronegativität besitzen, sind alle Elektronen schön gleichmäßig verteilt und daher ist das Molekül nicht polar.
Viele Substanzen, die typischerweise z.B. als Schmutz in unserer Kleidung vorkommen sind ebenfalls mehr oder weniger unpolare Kohlenwasserstoffe.
Mischbarkeit von Fett und Wasser
Dass sich Fett und Wasser nicht wirklich mischen lässt, kennt wohl jeder von uns aus dem Alltag, vor allem aus der Küche (Salatsoße, Fettaugen auf der Suppe). Es liegt daran, dass die polaren Wassermoleküle jeweils lieber unter sich bleiben und ebenso auch die unpolaren Fettmoleküle. Wenn man beispielsweise die Salatsoße schnell rührt, kann man kurzzeitig zwar eine Mischung erhalten (genauer, eine Emulsion), die sich jedoch über kurz oder lang wieder auftrennt. Allgemein gilt hier das Prinzip „Gleiches löst sich in Gleichem“ - deshalb löst sich z.B. Salz (das aus geladenen Ionen aufgebaut ist) gut in Wasser, aber nicht in Öl.
Seife – Vermittler zwischen zwei Welten
Seife ist eine spezielle Form der sogenannten Tenside. Vielleicht habt ihr bei den Inhaltsstoffen von Spülmittel oder Waschmittel schon einmal was von „anionischen Tensiden“ oder „kationischen Tensiden“ gelesen. Es sind allgemein Stoffe, die sich sowohl mit polaren als auch mit unpolaren Substanzen mischen lassen und so zwischen beiden „vermitteln“.
Sie können das, weil sie eine unpolare Seite besitzen und eine polare Gruppe an einem Ende – man kann sich den Aufbau so ähnlich wie ein Streichholz mit seinem Stiel und dem Kopf vorstellen.

Quelle
Die beiden Seiten nennt man zum einen lipophil/hydrophob, das heißt fettliebend/wasserhassend und zum anderen lipophob/hydrophil, also fetthassend/wasserliebend. Der Kopf ist in der Regel eine ionische, also geladene Gruppe und kann daher negative (anionisch) oder positive (kationisch) Ladung tragen. Es sind aber auch polare, nicht ionische Gruppen möglich (wie Wasser ein polares, aber nicht ionisches Molekül ist). Letztlich gibt es auch Tenside, die sowohl eine anionische als auch eine kationische Gruppe tragen. Diese nennt man amphoter oder zwitterionisch.
Ein Beispiel für solche Moleküle sind die oben erwähnten Fettsäuren. Wenn sie nicht mit dem Glycerin verbunden sind, haben sie mit der Kohlenstoffkette einen unpolaren lipophilen Teil und die Säuregruppe trägt in Wasser eine negative Ladung, ist daher hydrophil. Seife besteht aus solchen Fettsäuren, die aus den Fetten gewonnen werden. Man nennt die Spaltung der Fette in Säure und Glycerin daher auch „Verseifung“.
Funktionsweise der Tenside
Gibt man ein Tensid in Wasser, passiert folgendes: Der hydrophile Teil, also der Kopf, fühlt sich wohl, der lipophile Teil dagegen möchte dem Wasser aber aus dem Weg gehen. Bei nur geringer Menge Tensid passiert das in der Art, dass sich die Moleküle auf der Wasseroberfläche ansammeln und ihre Stiele nach oben in die Luft recken.

Quelle
Wenn die Oberfläche bedeckt ist und noch mehr Tenside vorhanden sind, passiert etwas anderes: Es bilden sich sogenannte Mizellen. Das sind im Prinzip kleine Kugeln, bei denen die Stiele der Tenside alle nach innen zeigen, also unter sich sind, und auf der Kugeloberfläche nur die Köpfchen sitzen, um für Abschirmung zu sorgen.
Gäbe man die Seife in eine Schüssel voll Öl, passiert grundsätzlich dasselbe, allerdings sind die Moleküle dann genau umgekehrt angeordnet.

Quelle
Kommt nun etwas von der jeweils anderen Flüssigkeit in unsere Mischung (meistens also Öl in das Seifenwasser), so schwimmt es nicht mehr an der Oberfläche, sondern schart die Tenside mit der lipophilen Seite um sich. Spätestens jetzt bilden sich Mizellen, bei denen das Fett im Inneren eingeschlossen wird. Da außen die hydrophilen Köpfchen sitzen, können die Öltropfen im Wasser gut verteilt und letztlich weggespült werden.

Quelle
Weitere Inhaltsstoffe und Besonderheiten bei Waschmitteln
Das Grundprinzip, nämlich hydrophobe Stoffe wie Fette „einzufangen“ und somit auszuwaschen, ist auch bei Waschmitteln identisch. Dennoch bestehen insbesondere Waschmittel nicht ausschließlich aus Tensiden.
Neben unseren Vermittlern sind beispielsweise Duft-, Farb- oder Konservierungsstoffe enthalten. Waschmittel können darüber hinaus auch noch Bleichmittel beinhalten und auch Enzyme. Das sind biochemische Stoffe, die bestimmte Reaktionen ermöglichen. Im Waschmittel können sie z.B. dafür sorgen, dass bestimmte Stoffe zersetzt werden. Darunter könnten z.B. Essensreste auf Kleidung, Hautschuppen oder natürliche Farbstoffe sein. Daneben gibt es spezielle Inhaltsstoffe, die beispielsweise das Abfärben von Kleidungsstücken verhindern sollen.
Zum Abschluss
Ich hoffe, ich konnte euch das grundlegende Prinzip hinter dem Waschen mit Seife geläufig machen. Natürlich hat jedes Produkt eine ganz eigene Zusammensetzung, die von den Herstellern teils für bestimmte Anwendungen optimiert wurde. Dennoch sind in allen Produkten irgendwelche Arten von Tensiden enthalten, um gängige Verunreinigungen zu entfernen. Wenn ihr mehr lesen wollt, verlinke ich euch als weitergehende Information die Wikipedia-Artikel. Natürlich gilt wie immer, dass man noch tiefer in die Materie einsteigen kann, aber das soll ja nicht Ziel dieser Serie sein.
Bis zum nächsten Mal!
This gem of a post was discovered by the OCD Team!
Reply to this comment if you accept, and are willing to let us promote your gem of a post!
If you accept this, you'll be nominated and the members of the OCD team will vote on whether we'll feature your post in our next compilation post.
You can follow @ocd – learn more about the project and see other Gems! We strive for transparency.
I'm mostly curating in #science and am always glad to see quality posts like yours peeking out between the garbage and plagiarism!
Thank you for your kind words! I'm glad that you like the post.
I'm thankful for your offer, so please feel free to promote the post. :-)