Der „Comet Assay“ [ger]
Diese Methode, etwas sperriger auch Einzelzellgelelektrophorese genannt, dient zur Erfassung von DNA-Schäden. Ein Einblick in die wissenschaftliche Praxis.

Wie kommt es nur, dass eine molekularbiologisch-toxikologische Methode nach einem astronomischen Objekt benannt ist? CC0, pixabay
Intro
So, jetzt aber. Nachdem wir die Grundlagen zum Thema Genotoxizität besprochen haben, will ich euch heute den Comet Assay näher bringen, mit dem ich mir die letzen Wochen so die Zeit vertrieben habe.
Auch wenn die Methode recht arbeitsintensiv und in der Durchführung teilweise etwas knifflig ist, ist sie um einiges verlässlicher als z.B. der ICE assay, den ich hier auch schon mal hatte. Der Comet liefert verlässliche, wertvolle (und hübsche^^) Daten, und hat sich daher zu einer gut etablierten Standard-Methode in der Toxikologie gemausert.
Also hmmm, wie fang ich am besten an? Ah ja, so:

Ziel und Auswahl des Versuchs
Wir wollen einen schädigenden/schützenden Einfluss einer Substanz oder eines Lebensstils auf die DNA messen. Wie gehen wir vor?
Erste Entscheidung: die Methode.
Je nachdem, welches Equipment uns zur Verfügung steht, welche Methoden in unserem Labor beherrscht werden, wie groß unser Budget ist, was wir genau untersuchen wollen und welcher Art unsere Proben sind, werden wir unterschiedliche Methoden wählen.
Der Comet Assay bietet sich an, wenn:
- im Labor ein Fluoreszenzmikroskop samt entsprechender Software vorhanden ist
- im Labor die Ausrüstung für eine Elektrophorese vorhanden ist (was eigentlich relativ selbstverständlich sein sollte, aber es in manchen Gegenden Europas wohl doch nicht ist…)
hust in Richtung @scienceangel… hier nachlesen… - wir direkt DNA-Strangbrüche in Zellen messen wollen, und nicht irgendwelche nachgelagerten Biomarker
- die Probe aus Zellen besteht, die sich vereinzeln lassen. Für Zellkultur und Blut funzt der Comet gut, für weiche Gewebe (z.B. Leber) geht’s grad noch, in Gewebeproben mit hohem Bindegewebsanteil (Darm etc.) ist die Methode zum Vergessen.
Die Methode
Schritt 1: Die Probe.
Wir haben uns für den Comet entschieden. Yay!
Du armer Trottel weiß noch nicht, dass du tagelang in der Dunkelkammer sitzen wirst. ;-P Aber Yay!
Bevor wir aber messen können, brauchen wir was zum Messen.
Seht ihr, wie unglaublich logisch Wissenschaft ist?
Viele Studien konzentrieren sich erstmal auf Effekte in der Zellkultur. In dem Fall kultiviert man sich Zellen in Flaschen oder Petrischalen, und wird diese dann mit der zu untersuchenden Substanz „inkubieren“. Nach der gewünschten Inkubationszeit (beim Comet in der Regel 1-24h) kann man die noch lebenden Zellen ernten und „vereinzeln“, so dass sie in Suspension vorliegen.
Hat man schon ausreichende Daten aus der Zellkultur, „geht man ins Tier“ oder in den Menschen. Dann kann man z.B. Blutproben ohne weitere Aufarbeitung für den Comet verwenden, da die Leukozyten ja frei im Blut herumschwimmen und bereits vereinzelt vorliegen.
Gewebeproben sind schwieriger und nur beschränkt machbar, da beim Vereinzeln gut haftender Zellen immer die Gefahr besteht, die Zellen vorzeitig zu töten. Eigentlich bietet sich für Gewebeproben ein anderer Assay, wie z.B. der Mikrokerntest, an.
Wie dem auch sei, ich bringe euch die Methode heute anhand meiner aktuellen Arbeit näher, und die verwenden Blutproben – genauer gesagt Rattenblut aus einem Tierversuch (über dessen Inhalt ich noch nicht reden darf und will).
Schritt 2: Das Einbetten.
Mit dem Blut machen wir folgendes:
Wir verwenden einen Zucker namens Agarose, um die Blutzellen auf einem Objektträger für die Mikroskopie „einzubetten“.
Agarose ist ein Stoff, der sich nur löst, wenn man ihn in Wasser aufkocht. Beim Abkühlen der Lösung bildet sich ein gallertenartiges, poröses Gel. Die Porengröße ist über die Agarose-Konzentration steuerbar – je geringer der Anteil an Agarose, desto größer die Poren.
Mit einer speziellen niedrigschmelzenden Agarose, die bei 37 °C noch flüssig ist, können wir die Zellen auf einem Objektträger einbetten, ohne dass diese beschädigt werden. Sie sind dann im Gel gefangen, während kleine Moleküle wie diverse Reagenzien jederzeit durch die Poren ins Gel eintreten und sich dort frei bewegen (="migrieren") können.
Schritt 3: Lyse
Jetzt ist es an der Zeit, die Zellen zu töten – aber dabei die DNA intakt zu lassen. Wir verwenden einen Lysepuffer mit starken Tensiden – im Prinzip nichts anderes als konzentriertes, abartig starkes Geschirrspülmittel, um die Membranen der Zelle – inklusive der Kernmembran – aufzulösen („Lyse“). Diese sind als Fette ja nicht wasserlöslich, aber unser Labor-Spülmittel leistet da ganze Arbeit.
Das Resultat: jetzt ist nicht mehr die intakte Zelle im Gel gefangen, sondern die freigelegte DNA in Form von Chromosomen, die ebenfalls zu groß sind, um durch die Poren zu migrieren.
Ab Schritt 3 arbeiten wir übrigens eisgekühlt, um keine thermischen Schäden an der DNA zu erzeugen. Den Zellen ist das jetzt auch schon wurscht.
Optionaler Schritt 3a: FPG
Ich muss kurz vorgreifen: Wie ihr sehen werdet, detektieren wir beim Comet Strangbrüche. Im letzten Post habe ich verschiedene Arten von DNA-Schäden erklärt. Wie ihr euch vielleicht (hoffentlich) erinnern könnte, stellen Strangbrüche nur eine Art der DNA-Schädigung dar. Die zweite große Möglichkeit ist eine Schädigung der DNA-Basen, die wir aber per Comet Assay nicht direkt detektieren können.
Dem kann aber Abhilfe geleistet werden, indem man die Objekttäger nach der Lyse mit einem speziellen Enzym namens Formamidopyrimidin-Glycosylase (kurz FPG) behandelt. Dieses ist eigentlich Teil der NER DNA-Reperatur und schneidet dort, wo es beschädigte Basen erkennt, ein Stück aus der DNA heraus.
Auf Deutsch: FPG „übersetzt“ beschädigte Basen in DNA-Strangbrüche, die dann von unsere Methode wieder erfasst werden können. Durch den Vergleich von nicht-FPG-behandelten und FPG-behandelten Objektträgern derselben Probe können wir nun über das Erfassen der gesamten Schäden hinaus sogar zwischen direkten Strangbrüchen und Schäden an Basen unterscheiden.
Ja ich weiß… G E N I A L!
Die Behandlung mit FPG muss im Dunkeln bzw. unter Rotlicht durchgeführt werden, um das Risiko, sich durch UV-Strahlung zusätzliche Schäden an der sehr sensiblen, weil nicht mehr durch Zellwände geschützten, DNA zu vermeiden:

Objektträger, Pipetten und sonstiges Zeug während der FPG-Behandlung
Schritt 4: Elektrophorese
Jetzt kommt das Kernstück der Methode.
Wie ich letztes Mal beschrieben habe, besitzt die DNA eine Phosphat-Kette, die ihr als „Rückgrat“ dient. Flashback in die Schulchemie: Phosphate sind Anionen, also negativ geladene Teilchen. Somit ist auch die DNA negativ geladen. Diesen Umstand kann man sich bei der Gelelektrophorese zu Nutzen machen.
Bei der klassischen Gelelektrophorese lädt man eine Mischung von DNA mit verschiedener Kettenläge in ein Agarosegel und legt dann elektrische Spannung an. Die negativ geladene DNA wird vom Pluspol angezogen (der Anode - die Anode heißt, weil sie Anionen anzieht - #eselsbrueckenfuerdeppertechemiker). Je nachdem wie groß die DNA-Stücke sind, werden sie schneller oder langsamer durch das poröse Gel migrieren können – daher trennen sie sich im elektrischen Feld nach Größe auf.
Beim Comet Assay – der Einzelzellgelelektrophorese – geschieht ähnliches. Wir packen unsere Objektträger mit den eingebetteten Zellen in eine Elektrophoresekammer, übergießen sie mit einer Pufferlösung und schalten den Strom an.
Intakte DNA ist zu fett, um durch die Poren des Gels zu wandern, und bleibt daher, wo sie ist. Geschädigte DNA aber zeichnet sich ja gerade durch das Auftreten von Strangbrüchen aus, enthält also kleinere DNA-Fragmente, die sehr wohl im Gel wandern können, und das im elektrischen Feld auch tun. So trennen wir geschädigte und ungeschädigte DNA!

mit Objektträgern gefüllte Elektrophoresekammer, ready to go
Dazu haben wir noch 2 Optionen: Wir können die Elektrophorese bei neutralem pH durchführen, bei dem die DNA-Doppelhelix intakt ist. Dann detektieren wir nur Doppelstrangbrüche (DSB), da bei einem Einzelstrangbruch (SSB) der komplementäre Strang ja noch intakt ist und die DNA zusammenhält, wodurch keine Fragmente entstehen, die im Gel wandern können.
Oder wir führen das Ganze im stark alkalischen Milieu (auf Deutsch: in ziemlich konzentrierter Natronlauge) durch, in dem sich Doppelstränge auftrennen („denaturieren“), und in dem wir daher auch SSBs methodisch erfassen. Dieser sogenannte „alkalische Comet Assay“ ist die gebräuchlichere Methode, da sie uns ein umfassenderes Bild liefert.
Schritt 5: Neutralisieren und Anfärben
Nach der Elektrophorese liegen intakte und geschädigte DNA räumlich getrennt voneinander am Objektträger vor. Wir müssen sie aber noch detektieren.
Dazu bedienen wir uns eines Fluoreszenzfarbstoffs, der an die DNA bindet und diese daher „anfärbt“. Ein sehr gebräuchlicher Farbstoff ist Ethidiumbromid (EtBr), das sich in die Doppelhelix einlagert („interkaliert“). Damit EtBr das tun kann, muss aber wieder doppelsträngige DNA vorhanden sein. Daher müssen wir die Objektträger zuvor neutralisieren, sprich einige Minuten in eine Pufferlösung mit neutralem pH stecken, wodurch die Spaltung der DNA in Einzelstränge rückgängig gemacht wird.
EtBr hat die unangenehme Eigenschaft, selbst krebserregend und mutagen wie Saus zu sein. Daher müssen wir beim Arbeiten ein paar zusätzliche Sicherheitsvorschriften beachten:

Faustregel: Wenn Chemiker mehr als ein Warnzeichen aufhängen, dann ist Feuer am Dach.
Im konkreten Fall heißt das: Schutzhandschuhe an, Labormanten und Brille an, nur im gekennzeichneten Bereich arbeiten, alle Materialien im Gefahrenmüll entsorgen und peinlichst darauf achten, mit bereits kontaminierten Handschuhen sonst nichts mehr zu berühren.
Schritt 6: Mikroskopie
Zu guter Letzt detektieren wir. Unter dem Mikroskop wird die angefärbte DNA mit einem Laser beschossen, der EtBr zur Fluoreszenz anregt, das daher zu leuchten beginnt und uns anzeigt, wo die DNA liegt.

Unser Fluoreszenz-Mikroskop… Zum Fotografieren hab ich das Licht mal ausnahmsweise aufgedreht. Arme Augen.
Wurde die DNA nicht geschädigt, ist während der Elektrophorese nicht gewandert und man sieht die intakte DNA in den Zellkernen kugelförmig und leuchtend:
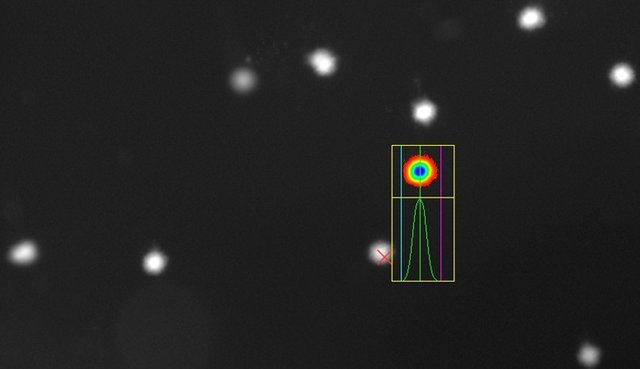
Bei einer Schädigung der DNA erkennt man nach wie vor den Zellkern, der aber nun wie ein Komet von einem „Schweif“ aus fragmentierter DNA, die im elektrischen Feld gewandert ist, begleitet wird:
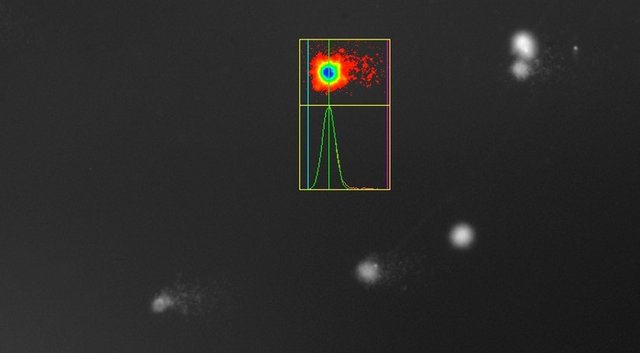
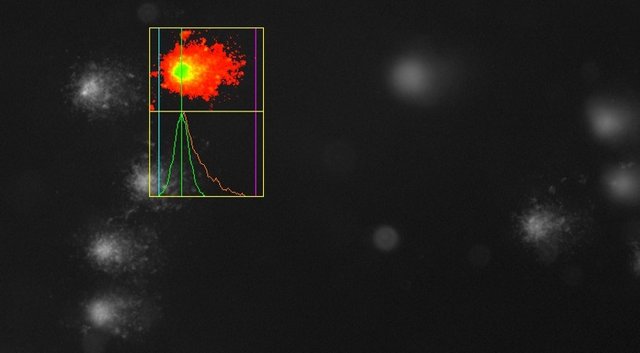
Schwache DNA-Schäden in einer Probe oben, starke Schäden in der UV-bestrahlten Positivkontrolle unten. Jetzt wisst ihr, warum der Versuch Comet Assay heißt!
Das Mikroskop-Bild wird von einer Kamera aufgenommen und an den PC gesendet, an dem eine spezielle Software es ermöglicht, die Zellen zu „scoren“. Dabei integriert man die Intensität des gesamten Zellkerns, des „Kopfes“ und des „Schweifes“. Die sogenannte Schweifintensität, also das Verhältnis der Intensität des Schweifes zur Gesamtintensität eines Kometen dient uns als Maß für die Intaktheit bzw. Schädigung der DNA.
Pro Objektträger werden 200 comets gescored, um einen aussagekräftigen Mittelwert bilden zu können. Dabei ist es wichtig, verblindet zu arbeiten:
Da der Operator (ich) theoretisch über die Auswahl der comets sowie über die Einstellung der scoring-Parameter das Ergebnis beeinflussen könnte (bewusst oder unbewusst), darf dieser nicht wissen, zu welcher Probe der Objektträger gehört, der gerade unter dem Mikroskop liegt. Diese tragen daher nur Nummern, und erst wenn alle Versuche erledigt sind, gibt mir meine Kollegin, die das Einbetten erledigt hat, eine Liste mit der Zuordnung der Nummern zu den tatsächlichen Proben.
Ihr seht, in der Wissenschaft vertraut man nicht mal sich selbst!
Fazit
Ich kriege 13 Objektträger am Tag geliefert und muss diese Lysieren (über Nacht), mit FPG behandeln, die Elektrophorese durchführen, anfärben (Teil 1) und dann scoren (Teil 2). Teil 1 geht für eine geübte Laborratte wie mich an einem Vormittag, Teil 2 bedeutet, den ganzen Nachmittag in der Dunkelkammer konzentriert auf einen Bildschirm zu starren. Vielleicht erklärt das, warum ich momentan kaum blogge. ;-P
Mit Ende der Woche ist es dann aber vorbei. Dann werde ich entblindet und kann endlich auswerten! Hoffentlich gibt’s fette DNA-Schäden.
Oh ja, wir Toxikologen freuen uns, wenn die giftige Effekte sehen, die wir dann publizieren können. So ist das.
Ich hoffe ich konnte euch hier einen kleinen Einblick in die wissenschaftliche Praxis und toxikologische Methodik bieten, bis bald, man liest sich!
Quellen und Bilder:
Bis auf das erste wurden alle Bilder von mir im Labor gemacht. Der Comet Assay wurde 1984 von Östling und Johannson erfunden, die bei uns im Labor durchgeführte und hier präsentierte Methode orientiert sich stark an den Modifikationen und Vorschlägen von Tice et al. aus dem Jahr 2000.
Mit solchen gut bebilderten Grundlagenartikeln kann ich ja leider nicht dienen. wieder in die Wissenschaft zurück will
Wie kommt es, daß der Einsatz dieser Methode bei Dir zeitlich begrenzt ist?
Na ja, ich bin inzwischen post doc und meine Arbeitszeit ist vermutlich zu teuer... äh wertvoll... als dass ich nonstop zum Durchmessen bei nur einer Methode eingesetzt werde. Diese konkrete Studie läuft über 6 Wochen, den Comet mache ich täglich frisch, dann mache ich mit den eingefrorenen Samples und anderen Methoden weiter. Inzwischen besteht ein Großteil meiner Arbeit aber aus Schreiben und Korrekturlesen.
Ich habe versucht, den Vorgang zu verstehen. Dabei habe ich mich die ganze Zeit gefragt, da ja das alles mikroskopisch winzige Materie (?) ist, ob die Wortwahl, die diesbezüglich getroffen wurde, lediglich eine Art Übersetzung in eine für den normalen Menschen verständliche Sprache ist oder ob tatsächlich die Form der DNA (als Doppelhelix und als Strang usw.) noch direkt unter einem sehr empfindlichen Mikroskop sichtbar ist oder ob ihr Chemiker hier schon in Metaphern redet?
Das Sichtbarmachen ist, wie ich es verstanden habe, ein sehr aufwändiger Akt.
Was geschieht eigentlich mit dem giftigen Labor-Müll? Weißt du darüber Bescheid?
Neulich wollte ich fast einen Artikel über Deodorants schreiben, habe es aber gelassen, weil ich die Fachliteratur dazu nicht verstanden habe. Es geht ums Aluminium in den Deos. Vielleicht wär das mal ein Thema? Bisher hatte ich immer angenommen, dass Christall-Deos besser wären, habe aber rausgefunden, dass sie mehr Alaun enthalten, als die herkömmlichen. Ist nun ein Christalldeo schädlicher als die?
Ja, bei mir ist irgendwie auch gerade Flaute. Wie es scheint, liest bei der Hitze niemand:)
Die DNA ist zu klein, um sie unter dem Mikroskop direkt sehen zu können. Was wir eben können, ist, dass wir leuchtende Farbstoffe wie z.B. EtBr benutzen, die sich an die DNA anheften. Dann können wir sagen, dass dort, wo unter dem Mikroskop am meisten "Leuchten" zu sehen ist, auch die meiste DNA lokalisiert ist. Aber als Helix oder Strang ist sie nicht sichtbar - Dafür bräuchte man ein Elektronenmikroskop, das aber mit dem herkömmlichen "Sehen" nichts mehr zu tun hat.
Beim Labormüll gibt es verschiedene Kategorien. Der giftigste, wie z.B. EtBr, wird luftdicht verschlossen und nie wieder geöffnet auf einer Sondermülldeponie gelagert.
Aluminium hatte ich schon mal, aber aus der Lebensmittel-Perspektive: link. Ist ein interessantes und durchaus kontroverses Thema.
Danke dir für die weitere Erläuterung und den Link zum Alu-Thema.
Gruselig. :/
Ja. Labor und Müll ist ein Thema, das ich lange schon mal abhandeln wollte. Wir verbrauchen leider unendliche Mengen an Plastik.
Ich glaube, ich könnte niemals in so einer Umgebung arbeiten.
Mein ultraneugieriges Ich würde die ganze Zeit sowas denken wie:
"Aaaaaach. SO schlimm wird es schon nicht sein. Ist bestimmt interessant, das einfach mal so anzufassen..."
Es würde sich nicht spektakulär anfühlen... Ist eine rötliche, neutral riechende, wässrige Lösung. Wie sie schmeckt, weiß ich nicht, vielleicht ist das spektakulär?
Mit der entsprechenden Einschulung kann das af jeden Fall jeder. Na gut, fast jeder, ich hatte schon Studenten die ich nichtmal Wasser pipettieren lassen würde, wenn es nach mir ginge...
Ich freu mich übrigens riesig, doch noch ein menschliches Kommentar auf den Post gekriegt zu haben, hatte schon Angst dass die Methodik einfach viiiiel zu langweilig zum Lesen ist. ;-)
Ist sie nicht. Ich bin begeistert, daß auch bei Euch die Dunkelkammer nicht ausstirbt.
An mir als Student würdest du vermutlich verzweifeln :D
Und gerne doch, ich lese deine Beiträge nahezu immer - und sei es, um doofe Kommentare zu schreiben :)
Ich verzweifle nicht sehr schnell. Meine Studenten müssen v.a. Lernbereitschaft, Humor und Verständnis für Sarkasmus mitbringen, und dürfen mich nicht gefährden.
Ok, am letzten Punkt könnte es bei dir scheitern.^^
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Hi @sco!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV