Estereoquímica y su importancia en la industria farmacéutica.
Saludos mis queridos amigos de Steemit, esta es mi primera publicación científica en apoyo al proyecto de @steemstem y @stem-espanol. En esta oportunidad tendré el agrado de hablarles sobre una rama de la Química que se encarga de estudiar la estructura tridimensional de los átomos que componen una determinada molécula y cómo afecta esto a las propiedades y reactividad de la misma, esta rama es denominada Estereoquímica.

Imagen realizada por mi persona @maryed, usando el programa PowerPoint 2013. La imagen de la molécula es de Vaccinationist, CC BY-SA 3.0- Fuente.
La imagen de fondo es de NIAID, CC BY 2.0 – Fuente.
En particular, hablaremos de compuestos que difieren entre sí sólo en la posición tridimensional que adoptan sus átomos en el espacio pero que no cambian su conectividad, es decir, el orden con el que se enlazan unos con otros. Estos compuestos reciben el nombre de estereoisómeros. La estructura tridimensional de los compuestos juega un papel importante dentro de la industria farmacéutica, ya que dicha característica es quizás uno de los factores más importantes que se deben de considerar en la síntesis de medicamentos pues esto permite evaluar las múltiples respuestas que el determinado medicamento pueda generar en nuestro organismo.


FIGURA I. Gif realizado por mi persona @maryed, usando el programa PowerPoint 2013 y PhotoScape. La imagen de la mano es de OpenClipart-Vectors, CC0 1.0- Fuente.
La  es un término empleado para nombrar a aquellos objetos que no son superponibles con su imagen especular (imagen en un espejo). Esta palabra proviene del griego “cheir” que significa mano, ya que el ejemplo más sencillo de un objeto quiral son nuestras propias manos: nuestra mano izquierda es la imagen especular de nuestra mano derecha y viceversa, pero éstas no son iguales ya que al ubicar una por encima de la otra se observa que no se pueden superponer, esto se observa en la Figura I. Por otra parte, aquellos objetos que sí son superponibles con sus respectivas imágenes especulares como un cubo o una esfera son aquirales.
es un término empleado para nombrar a aquellos objetos que no son superponibles con su imagen especular (imagen en un espejo). Esta palabra proviene del griego “cheir” que significa mano, ya que el ejemplo más sencillo de un objeto quiral son nuestras propias manos: nuestra mano izquierda es la imagen especular de nuestra mano derecha y viceversa, pero éstas no son iguales ya que al ubicar una por encima de la otra se observa que no se pueden superponer, esto se observa en la Figura I. Por otra parte, aquellos objetos que sí son superponibles con sus respectivas imágenes especulares como un cubo o una esfera son aquirales.
Todo objeto que sea tridimensional puede ser clasificado como quiral o aquiral. Las moléculas por ser tridimensionales pueden ser incluidas en alguna de estas dos categorías, pero ¿cuál es la causa de la Quiralidad en una molécula? La causa más común de la Quiralidad molecular es la presencia de un centro asimétrico: un átomo de carbono tetraédrico unido a cuatro sustituyentes DISTINTOS. Existen dos maneras posibles de organizar los cuatros grupos diferentes en torno al átomo central, originando dos estereoisómeros (Figura II). Estos dos estereoisómeros son imágenes especulares no superponibles, por lo que representan dos compuestos diferentes. Es importante señalar que si uno o más centros asimétricos de una molécula están unidos a dos o más grupos similares la molécula no poseerá un centro de quiralidad, por lo que será superponible con su imagen especular (la molécula y su imagen en el espejo son idénticas) y será aquiral. La existencia de un plano de simetría permite evaluar la quiralidad en torno al centro asimétrico.
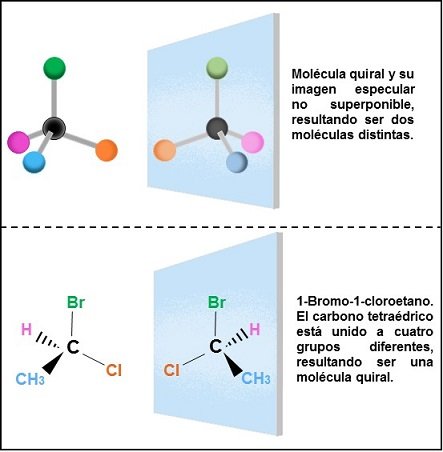
FIGURA II. Molécula quiral y su imagen especular no superponible (estereoisómeros). Imagen realizada por mi persona @maryed, usando los programas PowerPoint 2013 y Paint.
Las moléculas que son imágenes especulares entre sí reciben el nombre de  . El 1-Bromo-1-cloroetano y su imagen en el espejo de la Figura II representan un par de enantiómeros. Los enantiómeros poseen las mismas propiedades físicas, pero no sólo difieren en el intercambio de dos grupos en torno al centro asimétrico, existe una única propiedad que es característica para cada pareja de enantiómeros y que es útil para diferenciarlos uno del otro: la actividad óptica. Al hacer pasar luz polarizada en un plano a través de una muestra de uno de los dos enantiómeros el ángulo de polarización va a girar en una determina magnitud, al repetir el experimento con el otro enantiómero se observa que el ángulo de giro es el mismo sólo que en dirección opuesta. Puede ocurrir que se tenga una mezcla 50% de cada enantiómero, una mezcla racémica, ocasionando que la mezcla de los dos enantiómeros sea ópticamente inactiva. Atendiendo a la rotación de giro, un enántiomero se puede catalogar como:
. El 1-Bromo-1-cloroetano y su imagen en el espejo de la Figura II representan un par de enantiómeros. Los enantiómeros poseen las mismas propiedades físicas, pero no sólo difieren en el intercambio de dos grupos en torno al centro asimétrico, existe una única propiedad que es característica para cada pareja de enantiómeros y que es útil para diferenciarlos uno del otro: la actividad óptica. Al hacer pasar luz polarizada en un plano a través de una muestra de uno de los dos enantiómeros el ángulo de polarización va a girar en una determina magnitud, al repetir el experimento con el otro enantiómero se observa que el ángulo de giro es el mismo sólo que en dirección opuesta. Puede ocurrir que se tenga una mezcla 50% de cada enantiómero, una mezcla racémica, ocasionando que la mezcla de los dos enantiómeros sea ópticamente inactiva. Atendiendo a la rotación de giro, un enántiomero se puede catalogar como:
• Dextrorrotatorio: si rota el plano de la luz polarizada en el sentido de las agujas del reloj. Suele anteponerse la letra “d” o un signo positivo (+) al nombre del compuesto.
• Levorrotatorio: si rota el plano de la luz polarizada en sentido opuesto al de las agujas del reloj. Suele anteponerse la letra “l” o un signo negativo (-) al nombre del compuesto.
Es importante resaltar que la única manera de saber si un compuesto es dextro o levo es de forma experimental.
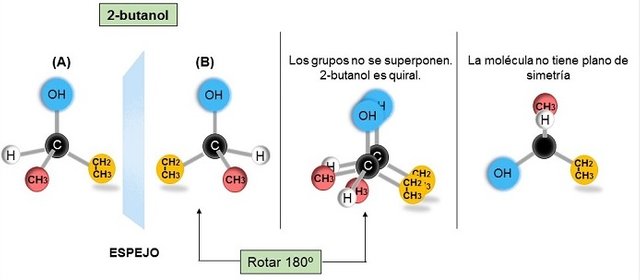
FIGURA III. (A) 2-butanol y (B) su imagen especular. Cuando (B) se rota 180º no se superponen, por tanto son enantiómeros. La molécula quiral no tiene plano de simetría.
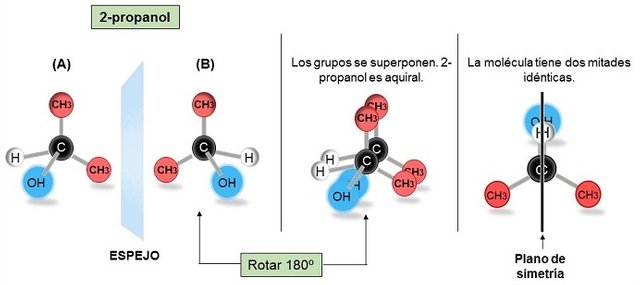
FIGURA IV. (A) 2-propanol y (B) su imagen especular. Cuando cualquiera se rota 180º se superponen, por tanto no son enantiómeros. La molécula aquiral tiene plano de simetría.
Imágenes realizadas por mi persona @maryed, usando el programa PowerPoint 2013.
Existe un sistema de nomenclatura empleado para identificar a cada enántiomero. Este sistema emplea la letras R y S, por lo que en cada par de enantiómeros uno de ellos tendrá la configuración S y el otro la configuración R. Para determinar la configuración respectiva se asignan prioridades basadas en los números atómicos o pesos moleculars unidos directamente al centro asimétrico, ocupando la posición #1 el átomo de mayor número atómico y la #4 el menor número atómico. Cabe destacar que no existe relación alguna entre la rotación óptica del compuesto con la nomenclatura R o S designada, existen enantiómeros R que son dextro o levo y enantiómeros S que pueden también ser dextro o levo. Esto porque la nomenclatura R y S es un criterio teórico impuesto no experimental.
Gran parte de los fármacos son compuestos quirales, esto porque en cierta forma nuestro organismo también lo es. La acción de un fármaco en nuestro cuerpo ocurre al momento en que este interactúa con un receptor o una enzima. Los receptores son macromoléculas que por lo general son de naturaleza proteica. La interacción fármaco-receptor es análoga a la unión de las piezas de un rompecabezas, pues sólo la molécula con la configuración adecuada “encajará” en el sitio activo del receptor y cuanto mejor sea esta afinidad, el fármaco presentará un efecto mayor.
Si el fármaco posee dos enantiómeros, la mayoría de las veces, ocurre que sólo uno de ellos posee la actividad terapéutica deseada ya que los receptores de nuestro organismo diferencian entre un enantiómero y otro, por lo que sólo pueden interactuar con uno de ellos en específico (son enantioselectivos), también puede ocurrir el caso de que uno de los enantiómeros produzca efectos secundarios nocivos o que incluso a pH fisiológico el enantiómero se racemice, es decir, se convierta parcialmente en el otro. Resumiendo lo anterior, pueden presentarse diferentes casos en la mezcla de los dos enantiómeros:
Caso I. Uno de los enantiómeros es inactivo dentro de la mezcla racémica.
Caso II. Un enantiómero presenta actividad terapéutica favorable, mientras que su contraparte presenta efectos secundarios perjudiciales.
Caso III. Ambos enantiómeros poseen beneficios positivos.
A continuación se mencionarán algunos ejemplos de cada uno de estos casos:
 Uno de los tantos ejemplos que podemos mencionar es el caso del Ibuprofeno. Como ya sabemos, el ibuprofeno es un antiinflamatorio empleado frecuentemente como analgésico, éste posee un carbono asimétrico y por lo tanto existe como un par de enantiómeros. El enantiómero (S)-ibuprofeno es el componente activo, mientras que el (R)-ibuprofeno es inactivo; a pesar de esto, el Ibuprofeno se comercializa como una mezcla de los dos enantiómeros. Estudios han demostrado que nuestro organismo es capaz de convertir el enantiómero R en el S en reacciones que se llevan a cabo lentamente.
Uno de los tantos ejemplos que podemos mencionar es el caso del Ibuprofeno. Como ya sabemos, el ibuprofeno es un antiinflamatorio empleado frecuentemente como analgésico, éste posee un carbono asimétrico y por lo tanto existe como un par de enantiómeros. El enantiómero (S)-ibuprofeno es el componente activo, mientras que el (R)-ibuprofeno es inactivo; a pesar de esto, el Ibuprofeno se comercializa como una mezcla de los dos enantiómeros. Estudios han demostrado que nuestro organismo es capaz de convertir el enantiómero R en el S en reacciones que se llevan a cabo lentamente.
 Es importante señalar que la mayoría de los medicamentos que son sintetizados en el laboratorio por lo general son vendidos como una mezcla racémica, siempre y cuando ninguno de los dos esteroisómeros no presente efectos secundarios nocivos, esto debido al alto costo económico sumado a la dificultad que implica separar a un enantiómero de la mezcla, ya que ambos enantiómeros poseen las mismas propiedades físicas. En otros casos, los enantiómeros pueden desencadenar respuestas fisiológicas totalmente opuestas como lo fue El gran desastre de la Talidomida.
Es importante señalar que la mayoría de los medicamentos que son sintetizados en el laboratorio por lo general son vendidos como una mezcla racémica, siempre y cuando ninguno de los dos esteroisómeros no presente efectos secundarios nocivos, esto debido al alto costo económico sumado a la dificultad que implica separar a un enantiómero de la mezcla, ya que ambos enantiómeros poseen las mismas propiedades físicas. En otros casos, los enantiómeros pueden desencadenar respuestas fisiológicas totalmente opuestas como lo fue El gran desastre de la Talidomida.
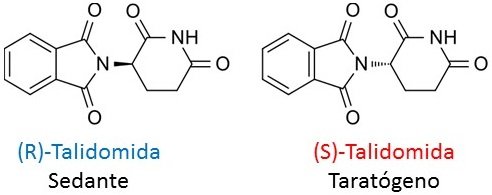
FIGURA V. Imagen modificada por mi persona @maryed, usando el programa PowerPoint 2013. La imagen de la molécula es de Fuse809, CC BY-SA- Fuente.
A finales de los años 50 y principios de los 60 una compañía farmacéutica europea sintetizó y posteriormente comercializó un medicamento dirigido a mujeres embarazadas durante la primera etapa del embarazo, la Talidomida servía como sedante y para calmar las náuseas, sus propiedades farmacológicas residían en la (R)-talidomida, pero se suministraba la mezcla racémica. Lo que en ese momento se desconocía era que la (S)-talidomida era un agente taratogénico, es decir, podía provocar malformaciones fetales. Este es un ejemplo en que el que los dos enantiómeros pueden generar resultados opuestos en nuestro organismo: uno de ellos produce una respuesta favorable, mientras que el otro produce una respuesta indeseable.
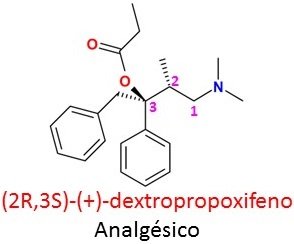
FIGURA VI. Imagen modificada por mi persona @maryed, usando el programa PowerPoint 2013. La imagen de la molécula es de Borislav Mitev, CC BY-SA 3.0- Fuente.
 En un tercer caso, existe la posibilidad de que ambos enantiómeros produzcan resultados favorables sobre nuestro organismo pero que a su vez son distintos, como en el caso de los esteroisómeros del propoxifeno. El enantiómero R,S (dextropropoxifeno) es un analgésico potente, mientras que su estereoisómero S,R (levopropoxifeno) es un antitusivo eficaz, fármaco empleado para tratar la tos seca. Son muy pocas las posibilidades de que ocurra que la combinación de ambos enantiómeros presente una ventaja dúal a nivel terapéutico y que uno contrarreste el efecto secundario del otro, el enantiómero R de la indacrinona es un diurético que ocasiona como efecto colateral en los pacientes el aumento del ácido úrico en la sangre; su contraparte, el enantiómero S aumenta la eliminación del ácido úrico por medio de la orina, es decir, es un uricosúrico. Este sería uno de los casos en que la comercialización de la mezcla racémica es justificable.
En un tercer caso, existe la posibilidad de que ambos enantiómeros produzcan resultados favorables sobre nuestro organismo pero que a su vez son distintos, como en el caso de los esteroisómeros del propoxifeno. El enantiómero R,S (dextropropoxifeno) es un analgésico potente, mientras que su estereoisómero S,R (levopropoxifeno) es un antitusivo eficaz, fármaco empleado para tratar la tos seca. Son muy pocas las posibilidades de que ocurra que la combinación de ambos enantiómeros presente una ventaja dúal a nivel terapéutico y que uno contrarreste el efecto secundario del otro, el enantiómero R de la indacrinona es un diurético que ocasiona como efecto colateral en los pacientes el aumento del ácido úrico en la sangre; su contraparte, el enantiómero S aumenta la eliminación del ácido úrico por medio de la orina, es decir, es un uricosúrico. Este sería uno de los casos en que la comercialización de la mezcla racémica es justificable.
Los efectos indeseables que trajo consigo uno de los enantiómeros de la talidomida fueron el punto de partida para que la comunidad científica, en particular los químicos sintéticos, se plantearan la necesidad de obtener enantiómeros puros y no en mezclas racémicas. A finales de los años sesenta, William Knowles comenzó a desarrollar una investigación basada en metales de transición como catalizadores quirales para llevar a cabo reacciones de hidrogenación que permitían obtener un enenatiómero en específico. Él centró su investigación en la síntesis de derivados de aminoácidos, ya que éstos compuestos son esenciales en los organismos vivos y con diversas aplicaciones en industrias como la farmacéutica o alimenticia. Éste método le permitió sintetizar la L-Dopa, un medicamento utilizado como tratamiento contra el Parkinson y en vista de todos los resultados positivos logrados con su investigación en el año 2001 fue galardonado con el Premio Nobel de Química catalogándose como el pionero en el área de la síntesis enantioselectiva.
Un punto que no está demás mencionar en esta publicación, es la aprobación de medicamentos para su posterior consumo. Con el paso de los años se han ido desarrollo nuevas medidas y parámetros estrictos en lo que respecta a la investigación preclínica y clínica para demostrar la efectividad y seguridad terapéutica de los fármacos y que finalmente puedan ser aprobados para su posterior comercialización.
A nivel internacional existen agencias encargadas de la regulación de los productos medicinales en pro de respaldar la seguridad de todos los consumidores así como también que los medicamentos comercializados sean efectivos. La más grande y reconocida de estas agencias es la FDA: Food and Drug Administration en Estados Unidos. Para que una molécula pueda ser aprobada para su comercialización debe atravesar un período de tiempo bastante largo (años) de ensayos en animales y humanos para demostrar su efectividad y seguridad, este proceso de investigación lleva consigo un gran esfuerzo científico así como también una gran inversión económica.
BIBLIOGRAFÍA CONSULTADA.
1. Cabildo, M. Cornago, M. Escolástico, C. Esteban, S. Farrán, M. Pérez, M. Sanz, D. PROCESOS ORGÁNICOS DE BAJO IMPACTO AMBIENTAL. Universidad Nacional de Educación a Distancia, Madrid, 2012. Página 47.
2. Camps, P. Escolano, C. Vázquez, S. QUÍMICA FARMACÉUTICA I. Tomo 1. Pubilicaciones y Ediciones de la Universidad de Barcelona, 2009. Página 29.
3. Klein, D. ORGANIC CHEMISTRY. John Wiley & Sons, Inc. 2nd edition. Página 188.
4. Claramunt, R. Cabildo, M. Escolástico, C. Gutiérrez, D. Jiménez, J. FÁRMACOS Y MEDICAMENTOS. Universidad Nacional de Educación a Distancia, Madrid, 2015. Página 106.
OTROS ARTÍCULOS.
1. Talidomida: una historia inacabada.
2. William S. Knowles y la importancia de la Síntesis Orgánica.

Espero que el contenido mostrado haya sido de tu agrado. Cualquier sugerencia o comentario que pueda mejorar esta publicación háganla llegar y con gusto les responderé. Sin más que decir me despido no sin antes enviarles un fuerte abrazo, mis queridos cibernautas.
Thank you for your post. :) I have voted for you: 🎁! To call me just write @contentvoter in a comment.
WARNING! The comment below by @wandoc leads to a known phishing site that could steal your account.
Do not open links from users you do not trust. Do not provide your private keys to any third party websites.
Hi @maryed!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Bienvenida @maryed a la comunidad científica #stem-espanol. Por favor lee las normas y criterios establecidos por ·steemSTEM, los puedes conseguir en mi blog. Normalmente los nuevos integrantes deben hacer una publicación con su presentación para darse a conocer. Suerte
Oh, excelente! Muchas gracias por la sugerencia!!
Se despide el equipo de Capybara Exchange.
Congratulations @maryed! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPLimited Time << 10 STEEM >> AIRDROP
This is a limited time offer only for first 2000 members who join and get 10 steem.
JOIN NOW